1、选择题 下列实验操作正确的是
A.将氢氧化钠固体放在滤纸上称量
B.用10?mL的量筒量取8.58?mL蒸馏水
C.欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
D.配制氯化铁溶液时,将一定量氯化铁固体溶解在较浓的盐酸中,再用水稀释到所需浓度
参考答案:D
本题解析:分析:A.氢氧化钠有腐蚀性;
B.10 mL量筒精确到0.1 mL;
C.pH试纸能润湿相当于将溶液稀释;
D.氯化铁中Fe3+能发生水解水解.
解答:A.NaOH易潮解且具有很强的腐蚀性,不能放在滤纸上称量,故A错误;
B.10 mL量筒达不到0.01 mL的精确度,故B错误;
C.pH试纸使用时不能润湿,否则相当于将溶液稀释,可能会产生误差,故C错误;
D.盐酸的存在能抑制Fe3+水解,故D错误.
故选D.
点评:本题考查化学实验基本操作,难度不大,注意pH试纸能润湿相当于将溶液稀释.
本题难度:简单
2、选择题 下列物质中含氢原子个数最多的是
A.5g H2
B.2mol H2O
C.23g C2H5OH
D.1mol NH3
参考答案:A
本题解析:分析:利用n=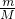 来计算物质的物质的量,再利用物质的构成来分析含有的氢原子,氢原子的物质的量越多,氢原子个数就越多.
来计算物质的物质的量,再利用物质的构成来分析含有的氢原子,氢原子的物质的量越多,氢原子个数就越多.
解答:A、氢气的物质的量为 =2.5mol,H原子的物质的量为2.5mol×2=5mol;
=2.5mol,H原子的物质的量为2.5mol×2=5mol;
B、2mol H2O中H原子的物质的量为2mol×2=4mol;
C、乙醇的物质的量为 =0.5mol,H原子的物质的量为0.5mol×6=3mol;
=0.5mol,H原子的物质的量为0.5mol×6=3mol;
D、1mol NH3中H原子的物质的量为1mol×3=3mol;
显然氢气中的氢原子的物质的量最大,则氢原子个数最多,
故选A.
点评:本题考查学生利用质量和物质的量的关系来计算,明确分子的构成是解答本题的关键,较简单,注重了对基础知识的考查.
本题难度:一般
3、选择题 与3.2克SO2所含的氧原子数相等的NO质量为
A.6.4克
B.3.2克
C.4.6克
D.3.0克
参考答案:D
本题解析:分析:根据n= 计算3.2克SO2的物质的量,氧原子数目相等则2n(SO2)=n(NO),据此计算NO的物质的量,在根据m=nM计算NO的质量.
计算3.2克SO2的物质的量,氧原子数目相等则2n(SO2)=n(NO),据此计算NO的物质的量,在根据m=nM计算NO的质量.
解答:3.2克SO2的物质的量为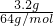 =0.05mol,氧原子数目相等则2n(SO2)=n(NO),所以n(NO)=2n(SO2)=2×0.05mol=0.1mol,所以NO的质量为0.1mol×30g/mol=3g.
=0.05mol,氧原子数目相等则2n(SO2)=n(NO),所以n(NO)=2n(SO2)=2×0.05mol=0.1mol,所以NO的质量为0.1mol×30g/mol=3g.
故选:D.
点评:考查常用化学计量的有关计算,比较基础,注意公式的掌握与灵活运用.
本题难度:一般
4、选择题 胶体和溶液的本质区别在于
A.胶体有丁达尔现象
B.分散质颗粒大小
C.溶液无色透明
D.胶体均一稳定
参考答案:B
本题解析:分析:当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm).
解答:当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),
所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小.
故选B.
点评:本题考查分散系、胶体与溶液的概念及关系,难度不大,注意胶体能透过滤纸但不能透过半透膜,所以可用渗析的方法提纯胶体.
本题难度:一般
5、选择题 下列变化中,属于物理变化的是
A.氧气溶于水
B.一氧化碳燃烧
C.钠溶于水
D.氢气燃烧
参考答案:A
本题解析:分析:本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在原子核不变的情况下,变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答:A、氧气溶于水,没有新物质生成,属于物理变化,故A正确;
B、一氧化碳燃烧有新物质生成,属于化学变化,故B错误;
C、钠溶于水与水反应有新物质氢氧化钠和氢气生成,属于化学变化,故C错误;
D、氢气燃烧有新的物质水生成,属于化学变化,故D错误.
故选A.
点评:搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.
本题难度:一般