1、选择题 所含分子数相同的一组物质是
A.1gH2和1gN2
B.1molH2O和1gH2O
C.3.2gO2和4.8gO3
D.44gCO2和16gO2
参考答案:C
本题解析:分析:物质的量相同,所含分子数目相同,根据n= 计算判断.
计算判断.
解答:A、1gH2和1gN2,二者物质的量之比与摩尔质量成反比为28:2=14:1,故二者含有分子数之比为14:1,不相等,故A错误;
B、1gH2O的物质的量为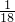 mol,二者物质的量不同,含有水分子数目不同,故B错误;
mol,二者物质的量不同,含有水分子数目不同,故B错误;
C、3.2gO2的物质的量为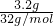 =0.1mol,4.8gO3的物质的量为
=0.1mol,4.8gO3的物质的量为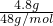 =0.1mol,二者物质的量相同,含有相同的分子数目,故C正确;
=0.1mol,二者物质的量相同,含有相同的分子数目,故C正确;
D、44gCO2的物质的量为1mol,16gO2的物质的量为0.5mol,二者物质的量不同,含有的分子数目不同,故D错误;
故选C.
点评:本题考查物质的量的有关计算,比较基础,旨在考查学生对基础知识的理解掌握,注意对公式的理解与灵活运用.
本题难度:一般
2、选择题 可用来检验Fe3+是否存在的试剂是
A.NaCl
B.CuSO4
C.KNO3
D.KSCN
参考答案:D
本题解析:分析:Fe3+遇KSCN溶液变为血红色,作为检验Fe3+的特征试剂,以此来解答.
解答:A.NaCl与Fe3+不反应,不能检验,故A不选;
B.CuSO4与Fe3+不反应,不能检验,故B不选;
C.KNO3与Fe3+不反应,不能检验,故C不选;
D.Fe3+遇KSCN溶液变为血红色,能检验Fe3+,故D选;
故选D.
点评:本题考查铁离子的检验,明确检验的试剂及现象是解答本题的关键,侧重物质性质的考查,题目较简单.
本题难度:简单
3、选择题 下列说法正确的是
A.1mol氧
B.SO42-的摩尔质量是96g
C.3mol小麦
D.标准状况下,1molO2和N2混合气体的体积约为22.4L
参考答案:D
本题解析:分析:A、没明确何种微粒.
B、摩尔质量的单位是g/mol
C、物质的量只能表示微观粒子不能表示宏观物质.
D、标准状况下,1mol任何气体的体积约为22.4L
解答:A、没明确何种微粒,氧指分子还是原子,故A错.
B、摩尔质量的单位是g/mol,SO42-的摩尔质量是96g/mol,故B错.
C、物质的量只能表示微观粒子不能表示宏观物质,小麦是宏观物质,故C错.
D、标准状况下,1mol任何气体的体积约为22.4L,任何气体既指一种气体又指混合气体,故D正确.
故选:D
点评:本题考查的是物质的量应用范围、摩尔质量、气体摩尔体积,气体摩尔体积使用时注意:必须在标准状况下,气体摩尔体积才是22.4L/mol,任何气体既指一种气体又指混合气体
本题难度:困难
4、选择题 若20g密度为dg/cm3的硝酸钙溶液里含有1gCa2+,则NO3-的物质的量浓度为
A.d/400mol/L
B.20/d?mol/L
C.2.5d?mol/L
D.1.25?mol/L
参考答案:C
本题解析:分析:根据V= 计算溶液的体积,根据n=
计算溶液的体积,根据n= 计算1g钙离子的物质的量,溶液中n(NO3-)=2n(Ca2+),再根据c=
计算1g钙离子的物质的量,溶液中n(NO3-)=2n(Ca2+),再根据c=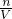 计算NO3-的物质的量浓度.
计算NO3-的物质的量浓度.
解答:1g钙离子的物质的量为 =0.025mol,所以溶液中n(NO3-)=2n(Ca2+)=0.05mol,
=0.025mol,所以溶液中n(NO3-)=2n(Ca2+)=0.05mol,
溶液的体积为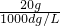 =
=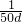 L,
L,
故NO3-的物质的量浓度为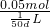 =2.5d?mol/L,
=2.5d?mol/L,
故选C.
点评:本题考查物质的量浓度的有关计算,难度不大,注意对公式的理解及钙离子与硝酸根离子的关系.
本题难度:简单
5、选择题 根据氧化物的常见分类方法,下列物质中与另外三种不属于同一类的是
A.Al2O3
B.Na2O
C.Fe2O3
D.CaO
参考答案:A
本题解析:分析:根据物质的性质不同对氧化物进行分类:和酸反应生成盐和水的氧化物为碱性氧化物;和碱反应生成盐和水的氧化物为碱性氧化物;即和酸反应又和碱反应生成盐和水的氧化物为两性氧化物;Na2O、Fe2O3、CaO属于碱性氧化物;Al2O3?是两性氧化物;
解答:Al2O3既和酸反应又和碱反应生成盐和水属于两性氧化物;Na2O、Fe2O3、CaO和酸反应生成盐和水属于碱性氧化物;
故选A.
点评:本题主要考查物质的分类,解答时要分析物质的性质,和酸和碱反应的特征分为酸性氧化物、碱性氧化物、两性氧化物;
本题难度:一般