1、填空题 碳是形成化合物种类最多的元素,氮元素可以形成多种化合物,氧是地壳中含量最多的元素。
回答以下问题:(12分,每空2分)
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少??(填化学式)的排放量.
(2)基态氮原子的价电子排布式是_________? ________。
(3)氧元素基态原子核外未成对电子数为?个。
(4)C、N、O三种元素第一电离能从大到小的顺序是____________。
(5)若某元素E的原子最外层电子排布为2s22 p1,某元素F的原子外围电子排布为2s22p2,则元素E与元素F的电负性从大到小顺序是_____? _______(用元素符号表示)。
元素F在元素周期表??区域(填s、p、d、ds、f区)
参考答案:(每空2分,计12分)
(1)CO2?(2)2s22 p3,?(3)2,?(4)N、O 、C
(5)C>B,?p
本题解析:(1)由于化工燃烧的大量使用,导致温室气体CO2的大量排放,现今所倡导的低碳生活,主要是为了减少CO2的排放
(2)基态氮原子的电子排布式是1s22s22 p3,其价电子即为最外层电子:2s22 p3
(3)氧元素基态原子的电子排布式是1s22s22 p4,在2p轨道上有2个未成对电子
(4)同周期元素的第一电离能随核电荷数的递增而增大,但由于N原子电子的半充满状态,导致第一电离能N>O>C
(5)E、F分别为硼与碳元素,同周期自左向右非金属性增强,电负性增大即:C>B
碳元素为p区元素
本题难度:简单
2、选择题 有关碳酸钠这种物质所属类别说法错误的是
A.从其组成的阳离子来看属于钠盐
B.从其组成的阴离子来看属于碳酸盐
C.碳酸钠可以称为正盐
D.碳酸钠俗称纯碱,可以称为碱式盐
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列各组微粒半径(R)之比大于1的是?
A.R(Mg)/R(Na)
B.R(P)/R(Cl)
C.R(Al3+)/R(Na+)
D.R(K)/R(Br)
参考答案:B、D
本题解析:同周期元素(主族),从左到右随着核电荷递增,原子半径、阳离子半径或阴离子半径都依次减小。钠和镁都位于元素周期表第3周期,钠在镁的左边,钠原子半径大于镁原子,R(Mg)/R(Na)小于1,A错。磷和氯都位于第3周期,磷在氯左边,磷的原子半径大于氯,R(P)/R(Cl)大于1,B对。钠和铝都失去外层电子成为阳离子,都具有两个电子层,铝的核电荷数大于钠。铝对核外电子吸引力大,铝离子的半径小于钠离子,它们的半径比值小于1,C错。钾和溴都位于第4周期,都是主族元素,钾的原子半径大于溴,两原子半径比大于1,D对。
本题难度:一般
4、选择题 元素周期表是学习化学的重要工具。下列关于元素周期表的说法不正确的是
A.第七周期的最后一个元素为118号元素
B.元素周期表中第1、2纵行又称为s区
C.元素周期表中ⅠA是包含元素种类最多的纵行
D.根据元素周期表可以预测元素的存在及其性质
参考答案:C
本题解析:A正确,根据元素周期表的结构分析可得第七周期的最后一个元素为118号元素;B正确,元素周期表中第1、2纵行最外层电子均以s能级存在,为s区;C错,元素周期表中IIIB是包含元素种类最多的纵行;D正确,根据元素周期表可以预测元素的存在及其性质
本题难度:简单
5、选择题 下列各组物质中,互为同位素的是(?)
A.T2O与D2O
B.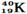 与
与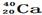
C.O2和O3
D.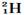 和
和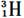
参考答案:D
本题解析:同种元素的不同原子互称为同位素,它们的质子数相同,但中子数不同。
本题难度:简单