1、填空题 (14分)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。C元素是地壳是含量最多的元素。D是短周期元素中金属性最强的元素。E与F的位置相邻,F的最高价氧化物的水化物为最强的酸。
(1)推断B在元素周期表中的位置:?。
(2)写出A与C形成的10电子的阳离子化学式:?。(用对应的化学符号填空,下同)
(3)E、F两种元素中非金属性较强的是?;用电子式表示D2C形成过程?
(4)D、E形成的正盐的水溶液中,阴离子的浓度大小顺序为:?(从大到小排列)。
(5)常温下,1molA元素的单质与C元素的单质化合,放出286kJ的热量,写出反应的热化学方程式:?
(6)甲是A和C按原子个数比1:1组成的化合物。已知甲的溶液能使酸性高锰酸钾溶液褪色。将含有0.5mol甲的溶液滴加到100mL? 2mol/L酸性高锰酸钾溶液中,溶液紫色恰好褪去,该反应的离子方程式为 ?
参考答案:(1) 第二周期?第IVA族?(2)H3O+
(3)Cl?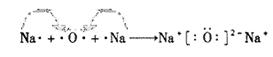 ?
?
(4)C(S2-)>C(OH-)>C(HS-)
(5)H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1 (其他合理答案也对)
(6) 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O
本题解析:“A元素原子核内无中子”,则A为11H;B元素的核外电子排布为2 4,则B为碳元素;“C是地壳中含量最多的元素”,则C为氧元素、;“D是短周期中金属性最强的元素”,则D为钠元素;“F与E位置相邻,F的最高价氧化物的水化物为最强的酸。,则F为氯元素、E为硫元素;(1)根据电子层数=周期序数,最外层电子数=主族序数,B在元素周期表中的位置第二周期?第IVA族?;(2)A与C形成的10电子的阳离子化学式:H3O+;(3)E、F两种元素中非金属性较强的是Cl;用电子式表示D2C形成过程 。(4)D、E形成的正盐是硫化钠,其水溶液呈碱性,阴离子的浓度大小顺序为:C(S2-)>C(OH-)>C(HS-)。(5)反应的热化学方程式:H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1;(6)甲是A和C按原子个数比1:1组成的,则甲为过氧化氢。已知甲的溶液能使酸性高锰酸钾溶液褪色,说明被高锰酸钾氧化了,0.5mol甲与0.2mol酸性高锰酸钾溶液恰好反应,即比值为5:2,据此信息则该反应的离子方程式为 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O。
。(4)D、E形成的正盐是硫化钠,其水溶液呈碱性,阴离子的浓度大小顺序为:C(S2-)>C(OH-)>C(HS-)。(5)反应的热化学方程式:H2(g) + 1/2O2(g) ="==" H2O(l)?△H=-286KJ·mol-1;(6)甲是A和C按原子个数比1:1组成的,则甲为过氧化氢。已知甲的溶液能使酸性高锰酸钾溶液褪色,说明被高锰酸钾氧化了,0.5mol甲与0.2mol酸性高锰酸钾溶液恰好反应,即比值为5:2,据此信息则该反应的离子方程式为 2MnO4-+5H2O2+6H+ = 2Mn2+ +5O2↑+8H2O。
本题难度:一般
2、填空题 m、n、x、y四种主族元素在周期表里的相对位置如右图所示。
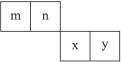
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的化学式为__________。
(2)y的单质通入石灰乳中所生成的具有漂白性,其漂白原理是__________________(用化学方程式表示)。
(3)x的原子结构示意图为___________________________________。
(4)检验y的-1价阴离子的离子方程式为____________________________。
参考答案:(1)NH3?(2)Ca(ClO)2? Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO?(3)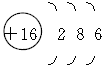 ?(4)Cl-+Ag+====AgCl↓
?(4)Cl-+Ag+====AgCl↓
本题解析:根据题意,m、n、x、y四种元素原子序数总和为46,其平均值小于12,因此m、n在第2周期,x、y在第3周期,设n的原子序数为a,则(a-1)+a+(a+9)+(a+10)=46,解得a=7,即m为C,n为N,x为S,y为Cl。
本题难度:简单
3、选择题 元素性质呈周期性变化决定因素是
A.元素半径大小呈周期性变化
B.元素相对质量依次递增
C.元素核外电子排布呈周期性变化
D.元素最高正化合价呈周期性变化
参考答案:C
本题解析:结构决定性质,即原子的核外电子排布尤其是最外层电子排布决定了元素的性质,所以
元素性质呈周期性变化的决定因素是元素原子核外电子排布呈周期性变化的必然结果,C正确。
本题难度:一般
4、选择题 已知x、Y是元素周期表中前20号元素,二者原子序数相差3,x、Y能形成化台物M,下列说法正确的是
A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径
B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性
C.若M属于离子化合物,则该化合物中只存在离子键
D.若M属于离子化台物,则该化合物中原子个数比可能为1:2
参考答案:D
本题解析:A、若X和Y处于同一周期,未指明X、Y的原子序数的大小关系,所以原子半径的大小无法判断,错误;B、若X和Y处于不同的周期,则M溶于水所得溶液有可能显中性,如氯化钙,错误;C、M是离子化合物如过氧化钠,该化合物中存在离子键、共价键,错误;D、M属于离子化台物,如CaCl2,原子个数比可能为1:2,正确,答案选D。
本题难度:简单
5、选择题 对于s轨道及s电子云,下列说法正确的是(?)。
A.某原子s轨道的能量随主量子数n的增大而增大
B.s电子在以原子核为中心的球面上出现,但其运动轨迹测不准
C.s能级有自旋方向相反的两原子轨道
D.s轨道的电子云图为球形,说明电子在空间各位置出现的机会相等
参考答案:A
本题解析:A项中,原子轨道的能量是由n和l共同决定的,对于l已确定的轨
道,n值越大能量越高,故A项正确;B项中,s轨道的电子云为球形对称,
向空间各处伸展方向相同,s电子在空间各处均可能出现,不限于出现在球
面上,故B项不正确;C项中,s能级只有一条原子轨道,故C项不正确;
D项中,s轨道的电子云图为球形,并不说明电子在原子核外空间各处出的
机会相等。在离核近的区域,电子出现的机会大,在离核远的区域,电子出
现的机会小。
本题难度:简单