1、选择题 已知X、Y、Z为三种由短周期元素构成的10个电子的粒子,其结构特点如下:
粒子代码
| ? X
| ? Y
| ? Z
|
原子核数
| ?单核
| ?两核
| ?四核
|
粒子的电荷数
| ?一个单位正电荷
| ?一个单位负电荷
| ? 0
|
物质A由X、Y构成,? B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①~⑤都是用于工业生产的反应,反应⑥中个别产物在图中略去。请填写下列空白:
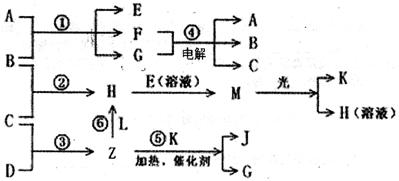
(1)Y的化学式是_______,Z分子的空间构型为_______,A的电子式为_______。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→M________________________________________________________
F+G→A+B+C_____________________________________________
(3)L是由3种元素构成的分子,能与Z以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,写出L的结构式:____________。
(4)常温下,实验室模拟工业反应④的过程如右图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=______。(假设气体完全逸出,溶液体积不变)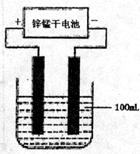
参考答案:

本题解析:略
本题难度:一般
2、选择题 同种元素的原子和离子,具有相同的(?)
A?核电核数? B?电子数? C?电子层数? D 化学性质
参考答案:A
本题解析:同种元素的不同微粒一定既有相同的核电荷数即质子数,答案选A。
本题难度:简单
3、选择题 Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成的化合物在水中能电离出电子层结构相同的离子,该化合物是?(?)
A.KCl
B.NaF
C.Na2O
D.K2S
参考答案:A
本题解析:X元素的最高正价与负价的代数和为6,最高正价和最低负价的绝对值的代数和为8,由此计算最高价+7,最低负价-1,X是第ⅦA主族的元素。
A、KCl中钾离子与氯离子电子层结构相同,氯元素处于第ⅦA主族,符合题意,故A正确.
B、NaF中离子有相同的电子层结构,但氟元素没有正化合价,故B错误;
C、Na2O中离子有相同的电子层结构,但氧元素没有正化合价,故C错误;
D、K2S中硫离子不是第ⅦA主族的元素,故D错误。
故选:A。
点评:本题考查元素的推断与物质的组成,推出Y为S元素是解答本题的关键,学生应学会利用原子结构来推断元素。
本题难度:简单
4、填空题 (13分) 有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)(5分)A是________,B是________,C是________,D是________,E是_________。(写元素符号)
(2)(2分)由这五种元素组成的一种化合物是(写化学式)_______________。写出该物质的一种主要用途。______________。
(3)(2分)用轨道表示式表示D元素原子的价电子构型____________________。
(4)(4分)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦)
参考答案:(1)H? O? Al? S? K?(2)KAl(SO4)2?12H2O?净水剂
(3)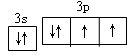 ?(4)O>S? Al>K
?(4)O>S? Al>K
本题解析:A和E属同一族,它们原子的最外层电子排布为ns1,说明AE都是第IA元素的。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,这说明最外层电子数是6个,因此是第ⅥA元素。C原子最外层上电子数等于D原子最外层上电子数的一半,所以C是第ⅢA元素。又因为C、E是金属元素,所以C是铝,B是氧元素,D是硫元素,E是钾元素,A是氢元素。
(2)由这五种元素组成的一种化合物是明矾,化学式为KAl(SO4)2?12H2O,主要用途是净水剂。
(3)硫原子的价电子是3s2和3p4,所以其轨道表示式是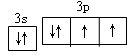 。
。
(4)非金属性越强,电负性越大,所以氧元素的电负性大于硫元素的。金属性越强,第一电离能越小,钾的金属性强于铝的,所以铝的第一电离能大于钾的。
本题难度:简单
5、选择题 某元素的原子核外有3个电子层,最外层有4个电子,则该原子核内的质子数为(?)
A.14
B.15
C.16
D.17
参考答案:A
本题解析:略
本题难度:简单