1、选择题 在“绿色化学实验进课堂”活动中,某同学为“氯气与金属钠反应”设计了下图装置与操作以替代相关的课本实验。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆大的金属钠(已擦净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是
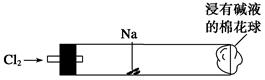
A.反应生成的大量白烟是氯化钠晶体
B.钠着火燃烧可用CO2灭火
C.玻璃管尾部浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.若在棉花球右侧外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
参考答案:B
本题解析:A、钠在氯气中燃烧,产生白烟,生成氯化钠晶体,正确;B、钠着火燃烧生成过氧化钠,Na2O2与CO2反应生成碳酸钠和氧气,故不能用CO2灭火,错误;C、氯气与氢氧化钠溶液反应,生成次氯酸钠、氯化钠和水,正确;D、氯气与碘化钾溶液能发生置换反应,淀粉遇生成的I2变蓝,正确。
本题难度:一般
2、选择题 将物质的量为0.2 mol的Na、Na2O、Na2O2、NaOH四种物质分别放入盛有100 mL水的甲、乙、丙、丁四个烧杯中,所得溶液的质量分数大小关系正确的是(? )
A.甲>乙=丙>丁
B.乙=丙>甲>丁
C.丙>甲>乙=丁
D.丙>乙>甲>丁
参考答案:B
本题解析:解题时,首先确定溶质为NaOH,甲、乙、丙、丁四个烧杯中NaOH的物质的量分别为0.2 mol、0.4 mol、0.4 mol、0.2 mol。再从溶液中的水考虑,分别减少0.2 mol、0.2 mol、0.2 mol、0 mol,然后再综合考虑,从而确定乙、丙中溶液的浓度相同,均大于甲、丁,而甲又大于丁,答案为B。
本题难度:简单
3、选择题 钙和钠相似,也能形成含O22-离子的过氧化物,下列叙述不正确的是?(?)
A.过氧化钙的化学式是CaO2
B.1 mol过氧化钙或过氯化钠跟足量的水反应都生成1mol氧气
C.O22-离子的电子式为
D.过氧化钙或过氯化钠都是强氧化剂
参考答案:B
本题解析:略
本题难度:一般
4、选择题 将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为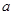 %和
%和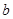 %的两种溶液,则
%的两种溶液,则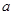 和
和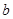 的关系是
的关系是
A.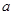 =
=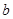
B.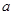 >
>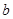
C.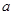 <
<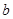
D.无法确定
参考答案:A
本题解析:等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,生成的氢氧化钠的物质的量相同,即溶液中溶质的质量相同,对于反应 ;1mol氧化钠与足量的水反应,溶液质量增加62g,对于反应
;1mol氧化钠与足量的水反应,溶液质量增加62g,对于反应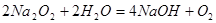 ,1mol过氧化钠与足量的水反应,溶液的质量增加62g,所以反应物两溶液的质量相同,即,则
,1mol过氧化钠与足量的水反应,溶液的质量增加62g,所以反应物两溶液的质量相同,即,则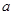 和
和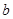 的关系是
的关系是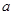 =
=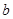
本题难度:一般
5、选择题 把xmLCO2通过足量的Na2O2后再与ymLNO混合,x与y之和为30mL。设充分反应后气体的体积缩小为15mL,则x:y为
①1:1?②2:1?③5:4?④7:5
A.①
B.②
C.①②
D.①②③④
参考答案:D
本题解析:有关反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2、2NO+O2=2NO2,即CO2+NO+Na2O2=Na2CO3+NO2。由于反应后气体的体积减小一半,因此只要CO2的体积不小于NO的体积即可,答案选D。2、NO和过氧化钠反应的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题,该题注重考查的学生的计算能力。该题的关键是通过反应原理,得出总的反应方程式即可。本题有利于培养学生的逻辑推理能力和灵活应变能力,提高学生分析问题和解决问题的能力。
本题难度:简单