1、选择题 下列离子方程式正确的是( )
A.钠与水反应:2Na+2H2O═2Na++2OH-+H2↑
B.氧化钠与盐酸反应:O2-+2H+═H2O
C.CaCO3悬浊液中通CO2:C032-+CO2+H2O═2HCO3-
D.小苏打溶液与NaOH溶液混合:HCO3-+OH-═CO32-+H2O
参考答案:A.钠与水反应生成氢氧化钠和氢气,离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.氧化钠和盐酸反应生成氯化钠和水,离子反应为Na2O+2H+═H2O+2Na+,故B错误;
C.CaCO3悬浊液中通CO2反应生成碳酸氢钙,离子反应为CaC03+CO2+H2O═Ca2++2HCO3-,故C错误;
D.小苏打溶液与NaOH溶液反应生成碳酸钠和水,离子反应为HCO3-+OH-═CO32-+H2O,故D正确;
故选AD.
本题解析:
本题难度:简单
2、填空题 除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关的离子反应方程式.
(1)Fe粉(Al粉):试剂______?离子方程式______;
(2)FeCl2溶液(FeCl3):试剂______?离子方程式______;
(3)NaHCO3溶液(Na2CO3):试剂______离子方程式______.
参考答案:(1)铁和铝都是金属,都和酸反应,但铝和氢氧化钠溶液反应,铁和氢氧化钠溶液不反应,所以可以选取氢氧化钠溶液作除杂剂,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
故答案为:NaOH溶液;?2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)FeCl2溶液中混有少量FeCl3,可加入铁粉,生成FeCl2而除去,反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:Fe;2Fe3++Fe=3Fe2+;
(3)Na2CO3能与二氧化碳反应生成碳酸氢钠,能除去杂质且没有引入新的杂质,符合除杂原则,故答案为:CO2;H2O+CO2+CO32-=2HCO3-;
本题解析:
本题难度:一般
3、选择题 下列离子方程式书写正确的是( )
A.铜片插入硝酸银溶液中?Cu+Ag+=Cu2++Ag
B.碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Ba2++s
═BaSO4↓
D.铁与稀硫酸反应:Fe+2H+═Fe2++H2↑
参考答案:A.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+=Cu2++2Ag,故A错误;
B.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═CO2↑+H2O+Ca2+,故B错误;
C.硫酸铜溶液与氢氧化钡溶液反应的离子反应为Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故C错误;
D.铁与稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 (1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸铜溶液的反应?
②碳酸钠和足量稀硫酸的反应?
(2)根据下列离子方程式,各写一个符合条件的化学 方程式
方程式
①Fe+2H+====Fe2++H2↑?
②HCO3-+ H+====CO2↑+ H2O??
参考答案:
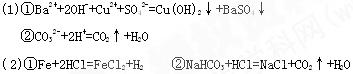
本题解析:略
本题难度:一般
5、简答题 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
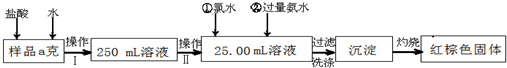
请根据上面流程,回答以下问题:
(1)操作?I?所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有______(填自选仪器名称),操作?II?必须用到的仪器是______?(从以下选项中选择,填编号).
A.50mL烧杯 B.50mL量筒?C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:______
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是______.
(4)若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:______.
(5)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是:
______?(用化学方程式表示)
参考答案:(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL容量瓶、胶头滴管;操作II是准确量取25.00mL的稀释后的溶液,故应需要滴定管,
故答案为:250mL容量瓶、胶头滴管;D;
(2)加氯水就是让+2价铁变为+3价,发生反应为2Fe 2++Cl2=2Fe 3++2Cl-;加氨水就是使+3价铁充分转化为Fe(OH)3沉淀,发生反应为Fe3++3NH3H2O=Fe(OH)3↓+3NH4+;
故答案为:2Fe 2++Cl2=2Fe 3++2Cl-、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;
(4)250mL溶液可以得到Fe2O3质量为10(W2-W1)g,铁元素的质量为10(W2-W1)g×112160=7(W2-W1)g,所以原氧化铁样品中铁元素的质量分数=7(W2-W1)a×100%;
故答案为:7(W2-W1)a×100%;
(5)样品溶于水,不加氯水,生成的氢氧化亚铁在蒸干加热时氢氧化亚铁会迅速被氧气氧化为氢氧化铁,加热最终转化为Fe2O3,不影响铁元素质量分数的测定,故该方案可行,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
本题解析:
本题难度:一般