1、填空题 (18分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Y元素在周期表中的位置是___________? __。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)?。
①原子晶体?②离子晶体?③分子晶体?④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________;U的氢化物的标准燃烧热为-890.31kJ·mol-1,请写出其燃烧的热化学方程式:??
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
参考答案:
 (1)N≡N;
(1)N≡N; ;第三周期ⅥA族。(2) ①③?
;第三周期ⅥA族。(2) ①③?
(3)CH4; NH3, CH4(g) +2O2(g)=CO2(g)+2H2O(l)?△H=-890.31KJ·mol-1。
(4)3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+, SO2。
本题解析:Y的单质在W2中燃烧的产物可使品红溶液褪色,所以Y是S,W是O元素;Z和W元素形成的化合物Z3W4具有磁性,因此Z是Fe。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,因此U是碳,X是镁。营业务U、V、W、X、Y、Z是原子序数依次增大的六种常见元素,所以V是氮元素。
(1)氮气中含有氮氮三键,所以气结构式是N≡N;XW是氧化镁,氧化镁是含有离子键的离子化合物,电子式为 。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
。S元素的原子序数是16,位于第三周期ⅥA族。由于氨水是弱碱,所以氨气极易结合氢离子生成NH4+。
(2)在碳元素形成的单质中金刚石是原子晶体,而C60是分子晶体,不存在离子晶体和金属晶体,答案选①③。
(3)U、V、W形成的10电子氢化物是甲烷、氨气和水。由于水分子间存在氢键,所以水的沸点最高,较低是甲烷和氨气。燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以热化学方程式是CH4(g) +2O2(g)=CO2(g)+2H2O(l)? △H=-890.31KJ·mol-1。
(4)由于硝酸具有氧化性,能把SO2氧化生成硫酸,而还原产物是NO,反应的离子方程式是3SO2+3Ba2+ +2H2O +2NO3- =3BaSO4↓+2NO↑ + 4H+。在氧化还原反应中还原剂的还原性强于还原产物的,所以还原性较强的是SO2。
本题难度:一般
2、填空题 (14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
|
C原子核外所有p轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
|
(1)A基态原子中能量最高的电子,其电子云在空间有?个方向,原子轨道呈?形。
(2)某同学根据上述信息,所画的B电子排布图如图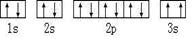 ,违背了?原理。
,违背了?原理。
(3)F位于?族?区,其基态原子有?种运动状态。
(4)CD3 中心原子的杂化方式为?,用价层电子对互斥理论推测其分子空间构型为?,检验E元素的方法是?。
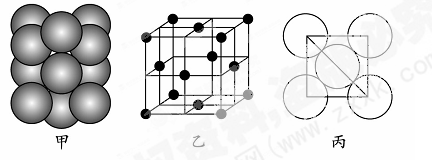
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为?,该单质晶体中原子的堆积方式为四种基本堆积方式中的?。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
参考答案:(1)3;纺锤形或哑铃形?(2)泡利不相容?(3)第三周期第ⅦB;d;25
(4)sp3;三角锥形;焰色反应?(5)12;铜型或面心立方堆积;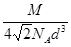
本题解析:A、B、C、D、E为短周期主族元素,原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,即A为N;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C原子核外所有p轨道全满或半满,结合原子序数可知,价电子为3s23p3符合题意,即C为P;D元素的主族序数与周期数的差为4,原子序数大于P,则D为第三周期第ⅦA族元素,即D为Cl;E是前四周期中电负性最小的元素,则E为K;F在周期表的第七列,则F为Mn,则
(1)A为N,能量最高的电子为2p电子,其电子云在空间有3个方向,p轨道为纺锤形;
(2)由泡利原理可知,电子在同一轨道内的自旋方向应相反,B基态原子的核外电子排布图中3s上的两个电子自旋方向相同,则违反了泡利原理;
(3)F为Mn,在第四周期第ⅦB,最后填充的为d电子,在d区,核外电子数为25,有25种运动状态不同的电子;
(4)PCl3中P原子孤电子对数为1,成键数为3,则为sp3杂化,空间构型为三角锥形,F为K,检验K元素应利用焰色反应;
(5)由晶胞结构可知,以顶点原子研究,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方堆积;由晶胞结构可知,晶胞中原子的数目为8×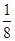 +6×
+6×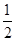 =4,该晶胞中原子的质量=4×
=4,该晶胞中原子的质量=4×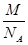 g,由信息可知晶胞图可知为面心立方,原子半径为dcm,由图丙可知,晶胞的棱长="4d" cm×
g,由信息可知晶胞图可知为面心立方,原子半径为dcm,由图丙可知,晶胞的棱长="4d" cm×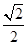 =2
=2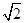 d cm,故晶胞的体积=(2
d cm,故晶胞的体积=(2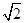 d cm)3=16
d cm)3=16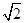 d3 cm3,所以其密度=
d3 cm3,所以其密度=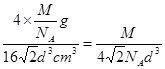 ?g/cm3。
?g/cm3。
本题难度:一般
3、填空题 [物质与结构](12分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol)
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|
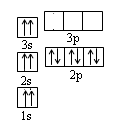
(1)某同学根据上述信息,推断B的基态原子核外电子排布如图所示,该同学所画的电子排布图违背了?。
(2)ACl2分子的空间结构为?(用文字描述)。
(3)我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,其中NO3-中N原子的杂化方式是??,与SO42-互为等电子体的分子是?。
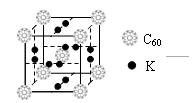
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其
晶胞如图所示,该物质在低温时是一种超导体。该物质的化学式?
为?。
(5)继C60后,科学家又合成了Si60、N60, Si60分子中每个硅原子只跟相 邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为?。
参考答案:(1)泡利不相容原理?
(2) 直线型?
(3) sp2? CCl4、CF4?等
(4) K3C60
(5) 30
本题解析:元素AB的第2和第3电离能相差较大,故两种原子最外层均为2个电子,但B的第一电离能小金属性强,故AB分别为Be和Mg。(1)该原子的s轨道均排了自旋方向相同的电子,故不符合泡利不相容原理;(2)BeCl2分子价电子对数为(2+2)÷2=2,故为sp杂化为直线型;(3)NO3-中氮的价电子对数为(5+1)÷2=3,为sp2杂化;SO42-互为等电子体的分子为CCl4、CF4?等;(4)该晶胞中黑球有12×1/2=6,C60有8×1/8+1=2,K原子和C60分子的个数比为3:1,化学式为 K3C60;(5)硅原子应形成4个公用电子对才能达到8电子稳定结构,但其只与3个原子成键,因此与其中一个原子形成双键,双键中含有1个π键,每个双键两个硅原子共用,计算为1×1/2×60 =30.
本题难度:一般
4、选择题 下列性质中,可以证明某化合物一定存在离子键的是
[? ]
A.晶体可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
参考答案:D
本题解析:
本题难度:简单
5、选择题 锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗元素处于最高价态,铋元素的价态与它跟氯元素形成共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构,可表示为
(BixGeyOz)n。则式中x等于
[? ]
A.2z-4y
B.
C.
D.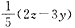
参考答案:B
本题解析:
本题难度:一般