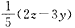1、填空题 (18分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;XW的电子式为____________;
Y元素在周期表中的位置是___________? __。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)?。
①原子晶体?②离子晶体?③分子晶体?④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________;U的氢化物的标准燃烧热为-890.31kJ·mol-1,请写出其燃烧的热化学方程式:??
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2还原性较强的是(写化学式)______________________________。
2、填空题 (14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素原子的核外p电子总数比s电子总数少1
|
B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期
|
C原子核外所有p轨道全满或半满
|
D元素的主族序数与周期数的差为4
|
E是前四周期中电负性最小的元素
|
F在周期表的第七列
|
(1)A基态原子中能量最高的电子,其电子云在空间有?个方向,原子轨道呈?形。
(2)某同学根据上述信息,所画的B电子排布图如图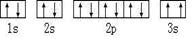 ,违背了?原理。
,违背了?原理。
(3)F位于?族?区,其基态原子有?种运动状态。
(4)CD3 中心原子的杂化方式为?,用价层电子对互斥理论推测其分子空间构型为?,检验E元素的方法是?。
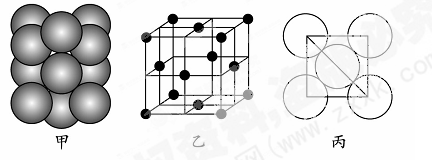
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为?,该单质晶体中原子的堆积方式为四种基本堆积方式中的?。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
3、填空题 [物质与结构](12分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol)
| I1
| I2
| I3
| I4
|
A
| 932
| 1821
| 15390
| 21771
|
B
| 738
| 1451
| 7733
| 10540
|
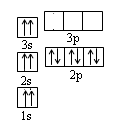
(1)某同学根据上述信息,推断B的基态原子核外电子排布如图所示,该同学所画的电子排布图违背了?。
(2)ACl2分子的空间结构为?(用文字描述)。
(3)我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,其中NO3-中N原子的杂化方式是??,与SO42-互为等电子体的分子是?。
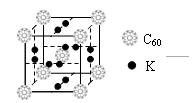
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其
晶胞如图所示,该物质在低温时是一种超导体。该物质的化学式?
为?。
(5)继C60后,科学家又合成了Si60、N60, Si60分子中每个硅原子只跟相 邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为?。
4、选择题 下列性质中,可以证明某化合物一定存在离子键的是
[? ]
A.晶体可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
5、选择题 锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗元素处于最高价态,铋元素的价态与它跟氯元素形成共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构,可表示为
(BixGeyOz)n。则式中x等于
[? ]
A.2z-4y
B.
C.
D.