1、填空题 向澄清石灰水中加入一定量的过氧化钠粉末,液体的体积变化不大,但可直接观察到其他的现象。请回答下列问题。
(1)一定能观察到的现象是____。
(2)可能观察到的现象是____。如果观察到了这种现象,你认为该现象出现的主要原因是_____________(只要答出两条即可)
参考答案:(1) Na2O2粉末立即消失,同时有无色气体从溶液中逸出
(2)澄清的液体变浑浊 ;①H2O与Na2O2发生化学反应,减少了溶剂的量,所以有一部分溶质析出,②Na2O2与H2O发生化学反应放出热量,液体温度升高使Ca(OH)2溶解度减小
本题解析:
本题难度:一般
2、选择题 mg过氧化钠和碳酸钠的固体混合物跟干燥的二氧化碳充分作用后,固体质量变为ng,则原混合物中过氧化钠的质量分数是
A.
B.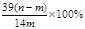
C.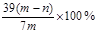
D.
参考答案:B
本题解析:
令过氧化钠的质量为mg,则:
2Na2O2+2CO2=2Na2CO3+O2?量增加△m
78×2? 56
mg?(n-m)g?
所以m=156(n-m)/56g
所以原混合物中过氧化钠的质量分数为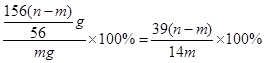
故选B.
本题难度:一般
3、计算题 某种碱金属的过氧化物11 g与二氧化碳气体完全反应后,固体质量增加了2.8 g,试判断此碱金属的相对原子质量是多少,是什么金属。
参考答案:设碱金属原子为R,其相对原子质量为x。
2R2O2+2CO2====2R2CO3+O2? Δm
2(2x+32)?2(2x+60)? 2(2x+60)-2(2x+32)=56
11 g? 2.8 g
 ? x=39
? x=39
即此碱金属原子相对原子质量为39,查元素周期表知是钾。
本题解析:要判断碱金属的相对原子质量,首先要写出化学方程式,然后以题给条件用差量法列比例式进行计算。
本题难度:简单
4、选择题 以下物质不能由两种单质直接反应得到的是
[? ]
A. SO2
B. SO3
C. MgO
D. Na2O2
参考答案:B
本题解析:
本题难度:一般
5、填空题 分在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末变蓝;当打开活塞(1)(2)时,D中蜡烛火焰变得更明亮;关闭活塞(1)时,A中反应可自行停止。

(1)装置B的淡黄色粉末是____________,?干燥管C中的白色固体应为_____________,
(2)A中发生反应的离子方程式为____________,
(3)B中发生的化学反应方程式为____________。
参考答案:(1) Na2O2(或过氧化钠)(1分), 无水硫酸铜(或CuSO4) (1分)?
(2)CaCO3+2H+===Ca2++CO2↑+H2O? (2分)
(3)2Na2O2+2CO2===2Na2CO3+O2(2分)
本题解析:在干燥管A中的块状白色固体为某种正盐,B中为淡黄色粉末是Na2O2,C中为白色粉末,并将A、B、C按图所示连接。打开活塞(1)(3)时,D中蜡烛火焰熄灭,C中白色粉末是CuSO4变蓝;当打开活塞(1)(2)时,气体通过B后产生O2,才使D中蜡烛火焰变得更明亮,即:2Na2O2+2CO2===2Na2CO3+O2;关闭活塞(1)时,A中反应可自行停止,说明A中是CaCO3固体,与烧杯中是盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O。
本题难度:一般