1、选择题 下列物质中,有一种物质的颜色与其它三种的颜色不同,这种物质是(?)
A.NaOH
B.Na2O
C.Na2O2
D.NaHCO3
参考答案:C
本题解析:NaOH ,Na2O,NaHCO3为白色,Na2O2?为淡黄色,故选C
本题难度:简单
2、选择题 在不同反应中既能吸收CO2,又能参加反应放出CO2的是
A.Na OH
B.Na 2CO3
C.NaHCO3
D.Ca(OH)2
参考答案:B
本题解析:B选项中Na2CO3+HCl=CO2+NaCl;Na2CO3+CO2+H2O=2NaHCO3。
点评:本题需熟练掌握钠的化合物性质及方程式。
本题难度:一般
3、选择题 关于NaHCO3性质的有关叙述正确的是(?)
A.既能与强酸反应,又能与强碱反应
B.医疗上可用于治疗胃酸过多
C.与足量的酸反应时放出的CO2比与等质量的Na2CO3要少
D.同温度时,NaHCO3的溶解度>Na2CO3溶解度
参考答案:AB
本题解析:碳酸氢钠和强碱反应生成碳酸盐,和强酸反应生成CO2,A正确;碳酸氢钠可用于医疗上治疗胃酸过多,B正确;碳酸氢钠的摩尔质量小于碳酸钠的,所以与足量的酸反应时放出的CO2比与等质量的Na2CO3要多,C不正确;在相同条件下,碳酸氢钠的溶解度小于碳酸钠的溶解度,D不正确,答案选AB。
点评:该题是高考中的常见题型,也是高考中的常见考点,属于中等难度的试题。试题基础性强,侧重对教材知识的巩固与训练,旨在培养学生灵活运用基础知识解决实际问题的能力。本题是常识性知识的考查,属于识记性的内容,记住即可。
本题难度:简单
4、选择题 将9.2 g金属钠投入到100 g下列不同质量分数的盐酸中,则放出的氢气(?)
①2.00%?②3.65%?③10%?④36.5%
A.①最少
B.④最多
C.③居中
D.一样多
参考答案:D
本题解析:因钠可以与水反应,所以Na与酸溶液反应产生H2的量不受酸的用量的限制。
本题难度:简单
5、选择题 标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
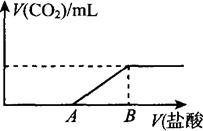
已知图中B点位置固定,V(B)="300" ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为?mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是?mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值
| V(A)=0
| 0<V(A)<150
| V(A)=150
| 150<V(A)<300
|
溶质的成分
| ①
| ②
| ③
| ④
|
?(3)取V(A)="100" mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是?。
参考答案:(1)3 (2分) 0.75(2分)
(2)①NaHCO3(1分)
②Na2CO3和NaHCO3(1分)
③Na2CO3(1分)
④Na2CO3和NaHCO3(1分);
(3)0≤V≤448(2分)
本题解析:由于反应后溶液的pH大于7,所以对应的溶质有如下几种情况,①NaHCO3
②Na2CO3和NaHCO3③Na2CO3④Na2CO3和NaHCO3,根据表中的数据分析可知每组对应的溶质。根据图像分析当气体体积达到最大值时,溶液中溶质只有NaCl,因此原溶液中氢氧化钠的物质的量等于此时加入盐酸的物质的量;V(A)=100时对应溶质为Na2CO3和NaHCO3,且二者物质的量之比为1:1,根据钠离子守恒可知各自的物质的量均为0.1mol,所以30mL溶液中含有的Na2CO3和NaHCO3的物质的量均为0.03mol,由于碳酸钠与盐酸反应时因滴加顺序不同对应反应不同,所以将盐酸滴加到混合溶液中产生气体体积为0,将混合溶液滴加到盐酸溶液中产生气体体积为448mL。
本题难度:简单