1、选择题 室温下,将1.000mol盐酸滴入20.00mL 1.000mol氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
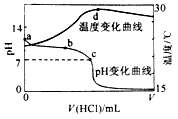
[? ]
A.a点由水电离出的
B.b点: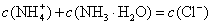
C.c点: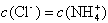
D.d点后,容易温度略下降的主要原因是电离吸热
参考答案:C
本题解析:
本题难度:一般
2、选择题 强弱电解质的本质区别是 (?)?
A.导电能力
B.相对分子质量
C.电离程度
D.溶解度
参考答案:C
本题解析:电解质的导电性只与溶液中离子浓度有关。即离子浓度越大,导电性越大强电解质指在溶液中完全电离。弱电解质指在溶液中部分电离。所以强电解质并非导电能力比弱电解质强,也就无法判断强弱电解质导电性谁强谁弱。
本质差别是在水溶液或熔融状态下能完全电离的化合物就是强电解质部分电离就是弱电解质
故选C
本题难度:简单
3、选择题 下列各组数据中,其比值为2:1的是( )
A.相同温度下,0.2mol?L-1乙酸溶液与0.1mol?L-1乙酸溶液中c(H+)之比
B.氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH+4):c(SO2-4)
C.Na2CO3溶液中,c(Na+):c(CO2-3)
D.pH=12的BA(OH)2溶液与pH=12的KOH溶液中,c[BA(OH)2]:c(KOH)
参考答案:A、弱酸的电离程度规律:越稀越电离,相同温度下,0.2mol?L-1乙酸溶液的电离程度不如0.1mol?L-1乙酸溶液的电离程度大,所以两溶液中c(H+)之比小于2:1,故A错误;
B、pH=7的溶液中,溶液显中性,则溶液中的氢离子和氢氧根浓度相等,根据电荷守恒:c(H+)+c(NH+4)=2c(SO2-4)+c(OH-),所以c(NH+4):c(SO2-4)=2:1,故B正确;
C、Na2CO3溶液中,碳酸根是弱离子,在溶液中会水解,所以c(Na+):c(CO2-3)>2:1,故C错误;
D、pH=12的Ba(OH)2溶液中,氢氧根浓度为0.01mol/L,所以与pH=12的KOH溶液中,c[Ba(OH)2]=0.005mol/L,pH=12的KOH溶液中,氢氧根浓度为0.01mol/L,c(KOH)=0.01mol/L,所以c[Ba(OH)2]:c(KOH)=1:2,故D错误.
故选B.
本题解析:
本题难度:一般
4、简答题 25℃时,几种弱酸溶液的pH如下表所示:
| 弱酸 | CH3COOH | H2SO3 | HCN
物质的量浓度mol/L
0.01
0.01
0.01
pH
3.4
2.3
5.6
|

(1)25℃时,Na2SO3溶液的pH______(填“>”、“<”“或“=”)7,其原因是______(用离子方程式表示).
(2)图1是常温下,相同pH的CH3COOH和HCN溶液分别加水稀释时溶液的pH随溶液体积变化的曲线.
①图1中曲线______(填“Ⅰ”或“Ⅱ”)表示加水稀释HCN溶液时pH的变化.
②下列操作能使CH3COOH的电离程度与同时增大的是______.
A.加水稀释溶液? B.升高溶液温度? C.加入少量NaHSO4固体? D.加入少量CH3COONa固体
③在图2中分别画出常温下CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与其盐浓度的变化曲线.
(3)常温下,物质的量浓度相同的CH3COONa溶液和NaCN溶液中,CH3COONa溶液中各离子浓度之和______(填“>”、“<”或“=”)NaCN溶液中各离子浓度之和.
(4)已知:HCN(aq)
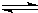
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1则NaCN在溶液中发生水解的热化学方程式:
CN-(aq)+H2O(1)
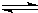
?HCN(aq)+OH-(aq)的△H=______.该反应25℃时的平衡常数K=______.
(需填具体数值,已知10-5.6=2.5×10-6)
参考答案:(1)25℃时,0.01mol/L亚硫酸的pH=2.3,则亚硫酸为弱酸,即亚硫酸钠为强碱弱酸盐,由SO32-+H2O

HSO3-+OH-可知溶液显碱性,pH>7,
故答案为:>;SO32-+H2O

HSO3-+OH-;
(2)①由表格中的数据可知,相同浓度的CH3COOH和HCN溶液,HCN的pH大,则HCN的酸性更弱,相同pH的CH3COOH和HCN溶液分别加水稀释时,醋酸的氢离子
浓度变化大于HCN中氢离子的浓度变化,则醋酸的pH变化大,所以曲线Ⅱ表示加水稀释HCN溶液时pH的变化,故答案为:Ⅱ;
②由CH3COOH

H++CH3COO-,加水稀释,促进电离,电离平衡正向移动,电离程度增大,c(H+)c(CH3COOH)增大,故A正确;
因弱电解质的电离是吸热的,则升高温度,电离平衡正向移动,电离程度增大,c(H+)c(CH3COOH)增大,故B正确;
加入少量NaHSO4固体,H+的浓度增大,电离平衡逆向移动,电离程度减小,故C错误;
加入少量CH3COONa固体,CH3COO-的浓度增大,电离平衡逆向移动,电离程度减小,故C错误;
故答案为:AB;
③由表格中的数据可知,酸性CH3COOH>HCN,CH3COONa溶液和NaCN溶液中都水解生成OH-,但相同浓度的盐时,NaCN溶液水解生成的OH-离子浓度大,
且盐的浓度越大,水解生成的OH-离子浓度也就越大,故答案为:
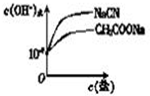
;
(3)物质的量浓度相同的CH3COONa溶液和NaCN溶液中,由电荷守恒可知CH3COONa溶液中存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
NaCN溶液中存在c(Na+)+c(H+)=c(CN-)+c(OH-),则两溶液中的离子浓度之和的比较即为2c(Na+)+2c(H+)的比较,
等物质的量浓度时,NaCN溶液水解生成的OH-离子浓度大,则2c(H+)就小,所以CH3COONa溶液中各离子浓度之和大,故答案为:>;
(4)HCN(aq)
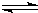
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1①,
H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ?mol-1②,
由盖斯定律可知反应CN-(aq)+H2O(1)
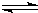
?HCN(aq)+OH-(aq)可由-①+(-②)得到,则反应热
△H═-(+43.5kJ?mol-1)+57.3kJ?mol-1=+13.8?kJ/mol,K=1Ka×Kw=0.012.5×10-6×2.5×10-6×10-14=1.6×10-5,
故答案为:+13.8?kJ/mol;1.6×10-5.
本题解析:
本题难度:一般
5、选择题 在足量锌与等物质的量浓度、等体积的盐酸和醋酸反应时,下列叙述正确的是
A.开始反应时,二者的速率相等
B.盐酸放出的H2多
C.二者放出的H2一样多
D.醋酸消耗的Zn的质量多
参考答案:C
本题解析:A、等浓度的等体积的盐酸和醋酸,因为醋酸电离程度小,所以氢离子浓度小,因此开始反应时,盐酸的反应速率大一点,错误;B、二者放出的氢气一样多,错误;C、正确;D、二者消耗的锌的质量一样多,错误。
本题难度:一般