1、选择题 下列装置或操作能达到实验目的是( )
A.

构成铜锌原电池
B.
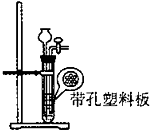
二氧化碳制取装置
C.
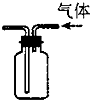
利用排空气法收集H2
D.

实验室制取并收集氨气
参考答案:C
本题解析:
本题难度:简单
2、计算题 利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
(1)该原电池的正极反应式为:?
(2)计算原稀硫酸的物质的量浓度。
(3)若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢??(填“能”或“不能”)若能组成原电池,此原电池的负极反应式是?
参考答案:(1)2H+ + 2e- = H2↑ (2分)?(2)0.75mol/L?(3分)
(3)能(1分),Zn — 2e- = Zn2+(2分)
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子,反应式为2H+ + 2e- = H2↑。
(2)氢气的体积是3.36L,物质的量是3.36L÷22.4L/mol=0.15mol。根据氢原子守恒可判断,硫酸的物质的量也是0.15mol,其浓度是0.15mol÷0.2L=0.75mol/L 。
(3)铁的活泼性也弱于锌的,所以能构成原电池,锌还是负极,铁是正极。其中负极反应式为Zn — 2e- = Zn2+。
本题难度:一般
3、选择题 按下图所示装置进行有关实验,则下列叙述正确的是
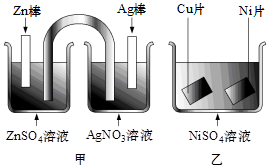
A.甲装置用作原电池时,锌为正极
B.甲装置用作原电池时,银棒上发生:Ag+ +e-= Ag
C.乙装置用作铜片镀镍时,镍作阴极
D.实现铜片表面镀镍时,可将甲中锌棒与乙中铜片相连,甲中银棒与乙中镍片相连
参考答案:BD
本题解析:A项甲装置用作原电池时,还原剂锌为负极,错误;B项甲装置用作原电池时,银棒(正极)上发生还原反应:Ag+ +e-= Ag,正确;C项乙装置用作铜片镀镍时,镍应该作阳极,错误;D项实现铜片表面镀镍时,可将甲中锌棒(负极)与乙中铜片相连作阴极,甲中银棒(正极)与乙中镍片相连作阳极,正确。
本题难度:一般
4、选择题 下列装置中能够形成原电池的是(?)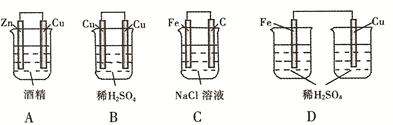
参考答案:C
本题解析:酒精为有机化合物,其不能作为电解质溶液,不能构成原电池,选项A错误;电解质溶液为稀H2SO4 ,但正负极都为Cu,不能有效构成原电池,选项B错误;选项D错误,缺少盐桥,无法有效组成原电池,故选C。
点评:该题是基础性的试题,也是高考中的常见考点之一;该题的关键是明确原电池的工作原理,然后结合相关知识灵活运用、分析、判断即可。考生平时应当多注重基础的延伸,侧重能力的训练。
本题难度:简单
5、选择题 下列说法正确的是( )
A.化学电池的放电过程就是电能转化为化学能的过程
B.化学电池中电子由正极流出,经外电路流向负极
C.燃料电池两极板均发生氧化还原反应
D.燃料电池工作时,通常是将氧气通向正极
参考答案:A、化学电池的放电过程是原电池的工作过程,所以化学电池的放电过程就是化学能转化为电能的过程,故A错误;
B、化学电池中电子流出的极是负极,电子由负极经外电路流向正极,故B错误;
C、燃料电池两极分别发生氧化还原反应中的一个半反应,两个半反应合并即为完整的氧化还原反应,故C错误;
D、燃料电池反应中,氧元素的化合价降低,通氧气的极是正极,燃料做负极,故D正确.
故选D.
本题解析:
本题难度:一般