1、填空题 (本题共8分)某研究小组向2 L密闭容器中加入过量的活性炭和0.2 mol NO,恒温(T1℃)下发生反应:C(s)+2NO(g) N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
1.该反应的平衡常数表达式K=______;T1℃达到平衡时,N2的平均反应速率=_______。
2.30 min后,若改变某一条件提高NO的转化率,则可以改变的条件是______________。
3.30 min后,升高温度至T2℃,达到平衡后,容器内NO、N2、CO2的关系不可能是____。
a.5:3:3 b.1:1:1 c.4:3:3 d.2:1:1
4.若开始时密闭容器的体积为1 L,其它条件不变,达到平衡后,与原平衡相比,下列说法正确的是_________。
a.NO的转化率不变 b.N2的浓度是原来的2倍
c.反应放出的热量为0.1Q d.达到平衡的时间是原来的一半
参考答案:(本题共8分,每小题2分)
1.K=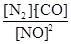 ;0.001 mol/(L?min)
;0.001 mol/(L?min)
2.降温、除去二氧化碳(2分)。
3.b、c(2分)。
4.a、b(2分)
本题解析:1、C(s)+2NO(g) N2(g) + CO2(g)
N2(g) + CO2(g)
初始: 0.2mol 0 0
△n 0.12mol 0.06mol 0.06mol
30 min: 0.08mol 0.06mol 0.06mol
3、30 min平衡时三气体的物质的量比为:4:3:3;升温则平衡左移,NO增多,而另外二者减少
4、若开始时密闭容器的体积为1 L,可理解为加压,平衡不移动,但各气体的浓度等倍数增加。
本题难度:困难
2、填空题 用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下: ?
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g)+Q(Q>0) ?
Si3N4(s)+12HCl(g)+Q(Q>0) ?
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2?L,3?min后达到平衡,测得固体的质量增加了2.80?g,则H2的平均反应速率___?mol/(L·min);该反应的平衡常数表达式K=_____
(2)上述反应达到平衡后,下列说法正确的是________。 ?
a.其他条件不变,压强增大,平衡常数K减小 ?
b.其他条件不变,温度升高,平衡常数K减小 ?
c.其他条件不变,增大Si3N4物质的量平衡向左移动 ?
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。 ?
a.3v逆(N2)=v正(H2)?b.v正(HCl)=4v正(SiCl4)? ?
c.混合气体密度保持不变?d.c(N2):c(H2):c(HCl)=1:3:6?
(4)若平衡时H2和HCl的物质的量之比为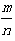 ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___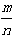 ?(填“>”、“=”或“<”)。
?(填“>”、“=”或“<”)。
参考答案:(1)0.02; ?
?
(2)bd?
(3)ac?
(4)<
本题解析:
本题难度:一般
3、选择题 下列各表述与示意图一致的是
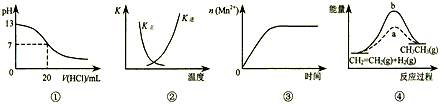
[? ]
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g) 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
参考答案:B
本题解析:
本题难度:一般
4、选择题 图为某化学反应的速率-时间图。在t1时刻升高温度或增大压强,都符合如图所示变化的反应是
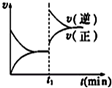
A.SO2(g) + O2(g) = 2SO3(g)△H < 0
B.C(s) + H2O(g) =" CO(g)" + H2(g)△H > 0
C.H2(g) + I2(g) = 2HI(g)△H > 0
D.4NH3(g) + 5O2(g) =" 4NO(g)" + 6H2O(g) △H < 0