|
高考化学知识点整理《化学平衡》高频试题强化练习(2020年最新版)(四)
2021-06-11 06:13:22
【 大 中 小】
|
1、选择题 对于平衡体系:aA(g)+bB(g)?cC(g)+dD(s)△H<0,下列判断中正确的是( )
A.若(a+b)<(c+d),则反应一定能自发向右进行
B.若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比也为a:b
C.若a+b=c+d,在平衡体系中共有气体mmol,再向其中充入nmolB,则达到平衡时气体总物质的量小于(m+n)mol
D.若a+b=c,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大
参考答案:A.D为固体,若(a+b)<(c+d),则△S不一定大于0,当△G=△H-T?△S<0时,反应才能自发进行,故A错误;
B.若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比1:1,故B错误;
C.D为固体,再向其中充入nmolB,平衡向正反应方向移动,气体的总物质的量减小,则达到平衡时气体总物质的量小于(m+n)mol,故C正确;
D.反应放热,升高温度平衡向逆反应方向移动,a+b=c,则反应前后气体的物质的量不变,在同体积下,温度越高压强越大,则升高温度容器中气体的压强增大,故D正确.
故选CD.
本题解析:
本题难度:一般
2、选择题 下列事实不能用勒夏特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.温度过高对合成氨不利
D.常温下,将 1 mL PH = 3的醋酸溶液加水稀释至100mL,测得其PH<5
|
参考答案:B
本题解析:A、FeCl3+3H2O Fe(OH)3+3HCl,加热时HCl受热挥发,降低了生成物的浓度,使平衡右移,符合勒夏特列原理;B、钢铁生锈,是电化学没有可逆反应,不符合勒夏特列原理;C、合成氨是放热反应,升高温度,平衡左移,符合勒夏特列原理;D、CH3COOH Fe(OH)3+3HCl,加热时HCl受热挥发,降低了生成物的浓度,使平衡右移,符合勒夏特列原理;B、钢铁生锈,是电化学没有可逆反应,不符合勒夏特列原理;C、合成氨是放热反应,升高温度,平衡左移,符合勒夏特列原理;D、CH3COOH CH3COO-+H+,加水稀释离子浓度降低,平衡正向移动,符合勒夏特列原理。因此答案选B。 CH3COO-+H+,加水稀释离子浓度降低,平衡正向移动,符合勒夏特列原理。因此答案选B。
考点:考查化学反应原理等相关知识。
本题难度:一般
3、简答题 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5
n(NO)(mol)
0.020
0.01
0.008
0.007
0.007
0.007
|
(1)已知升高温度,NO2的浓度减小,则该反应是______热反应.
(2)如图中表示NO2的变化的曲线是______
用O2表示从0~2s内该反应的平均速率v=______
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离除NO2气体?b.适当升高温度
c.增大O2的浓度?d.选择高效催化剂.
参考答案:(1)升高温度,平衡向吸热反应方向移动,NO2的浓度减小,则平衡向逆反应方向移动,所以正反应是放热反应,
故答案为:放;?
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b,
0~2s内v(NO)=0.020-0.00822mol/(L.min)=0.0030mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为?0.0015mol/(L?s),
故答案为:b,0.0015mol/(L?s);?
(3)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;?
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;?
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
故选c.
本题解析:
本题难度:一般
4、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
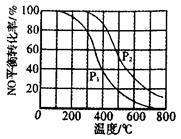
①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
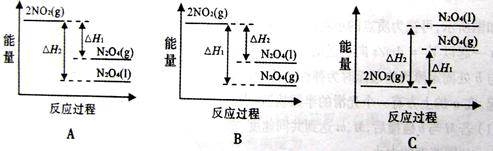
(2)已2NO2(g) N2O4(g) △H1<0 N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0 N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)
(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
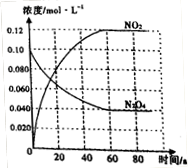
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
参考答案:(1)① <(1分) ②逐渐减小(1分) (2)A(2分)
(3)① 0.0020(2分) ②>(2分)
③反应达平衡时N2O4的浓度减少0.0020 mol/(L·s) ×10s=0.020 mol/L(1分)
N2O4(g)  2NO2(g) 2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
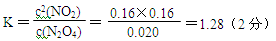
(4)负极(1分) 3O2+ 6H2O + 12e-=12OH-(2分)
本题解析:(1)①反应是气体体积减少的反应,温度相同时压强越大,平衡向正向移动,NO的转化率就越大,P2下的转化率比P1大,故P2较大,则P1<P2,②压强相等时,温度升高NO的转化率减小。故升高温度平衡向逆向移动,平衡常数减小。(2)反应的△H<0,所以反应是放热反应,NO2的能量较高,同种物质气态的能量比液态高,故A对。(3)①从图看出0~60s 时段,NO2的浓度改变了0.12mol/L,则NO2反应速率为:0.12mol/L÷60s=" 0.0020" mol/(L·s)。 ②2NO2(g) N2O4(g) △H<0则N2O4(g) N2O4(g) △H<0则N2O4(g) 2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分) 2NO2(g),是吸热反应,改变温度后NO2(g)的浓度增大,故平衡向正向移动,所以是升高温度,则T>50℃。③反应达平衡时N2O4的浓度减少0.0020mol/(L·s) ×10s=0.020mol/L(1分)
N2O4(g)  2NO2(g) 2NO2(g)
c开始(mol/L) 0.040 0.12
c平衡(mol/L) (0.040-0.020)(0.12+0.020×2)(2分)
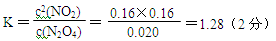
(4)从反应方程式看出N 的化合价升高,失去电子,故在负极反应;NH3在负极反应,那么O2在正极反应,电解质溶液是碱性的,电极反应为:3O2+ 6H2O + 12e-=12OH-(2分)
考点:化学平衡图像、化学平衡的移动、化学平衡常数的计算、燃料电池的工作原理。
本题难度:困难
5、填空题 合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题: 2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________ 46.2 kJ(填“<”、“>”或“=”)。
(3)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0? B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0?D.ΔH<0,ΔS<0
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率________。若升高温度,K值变化________(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是________(填字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.分离出氨气
参考答案:(1)减小 减小 (2)< (3)D (4)33.3% 减小 (5)A、D
本题解析:(1)在反应体系中加入催化剂,降低了反应的活化能,即E1减小,E2减小,反应热不变。
(2)由图像可知N2(g)+3H2(g)?2NH3(g) ΔH=-92.4 kJ·mol-1,使用催化剂,加快了反应速率,但平衡并不移动,平衡转化率不变,上述反应仍不能进行彻底,故0.5 mol N2和1.5 mol H2充分反应后放出的热量应小于46.2 kJ。
(3)由图可知ΔH<0,根据反应方程式可知气体的物质的量减小,ΔS<0。
(4)? N2(g)+3H2(g)?2NH3(g)
起始:? m ?n?0
转化:? x?3x ?2x
平衡:? m-x? n-3x?2x
根据题意m-x=0.1 mol n-3x=0.3 mol 2x=0.1 mol
故x=0.05 mol m=0.15 mol n=0.45 mol
α(H2)=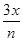 = =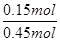 ×100%=33.3%。 ×100%=33.3%。
ΔH<0,升温,平衡左移,K值减小。
(5)欲提高H2的转化率应使平衡右移,向容器中按原比例再充入原料气,相当于增大压强,平衡右移,A可行,B中充惰性气体对平衡无影响,C中改变催化剂不改变平衡移动,D中分离出氨气,平衡右移,方法可行,故选A、D。
本题难度:一般
| 