|
高考化学必考知识点《气体的净化、干燥、吸收与收集》高频试题预测(2020年最新版)(四)
2021-06-11 06:14:05
【 大 中 小】
|
1、选择题 用图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
A.气体是NO2;a为浓硝酸;b为铜片;c为NaOH溶液
B.气体是SO2;a为浓硫酸;b为Cu;c为酸性品红溶液
C.气体是NH3;a为浓氨水;b为生石灰;c为浓硫酸
D.气体是CO2;a为稀盐酸;b为CaCO3;c为饱和NaHCO3溶液
| 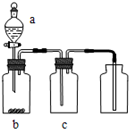
参考答案:A、NO2与NaOH反应而被吸收,不能用NaOH溶液净化,故A错误;
B、浓硫酸与金属铜的反应需在加热的条件下进行,而本实验没有加热,故B错误;
C、氨气密度比空气小,不能用向上排空法收集,故C错误;
D、盐酸与碳酸钙在常温下发生反应,二氧化碳不溶于饱和碳酸氢钠溶液,可用饱和碳酸氢钠溶液净化,并且二氧化碳密度大于空气,可用向上排空法收集,故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 不能用排空气法收集的气体是
A.H2
B.CO2
C.NO
D.O2
参考答案:C
本题解析:密度和空气的很接近,或者和空气发生化学反应的不能用排空气法收集。NO极易被氧气氧化生成NO2,所以不能用排空气法收集,可用排水法收集。氢气用向下排空气法,CO2和氧气用向上排空气法收集。答案选C。
本题难度:简单
3、选择题 实验室制取氯气的试管壁上粘附有MnO2,除去粘附的MnO2可用的试剂是( ?)
A.蒸馏水
B.氢氧化钾溶液
C.稀盐酸
D.热的浓盐酸
参考答案:D
本题解析:略
本题难度:简单
4、选择题 在下列气体中,不能用排水法收集的是?(?)
A.氨气
B.氧气
C.氢气
D.一氧化氮
参考答案:A
本题解析:略
本题难度:简单
5、填空题 (10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
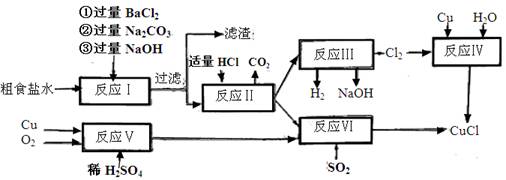
(1)反应I中加Na2CO3溶液的作用是?。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为?。
(3)①写出反应V的化学方程式?
②写出反应VI的离子反应方程式?。
(4)在整个合成过程中可以循环利用的物质是?
(5)反应IV加入的Cu必须过量,其目的是?。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是? ?。 ?。
参考答案:(10分,每空2分)
(1)除去Ca2+和过量的Ba2+(2分)
(2)2Cl—2e-=Cl2↑(2分)
(3)①2Cu+O2+2H2SO4=2CuSO4+2H2O(3分)
②2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4(3分)
或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4
(4)H2SO4? NaOH (可以写名称各1分))(共2分)
(5)在防止生成CuCl2(2分)
(6)加快乙醇和水的蒸发,(1分)防止CuCl被空气氧化(1分) (共2分)
本题解析:反应I是粗盐不的除杂过程,过滤后的滤液中加入适量盐酸(反应II),得到纯净的NaCl溶液;反应III是电解食盐水得到氯气,与铜、水一起制取CuCl。
反应V是制取硫酸铜,与SO2、NaCl通过反应VI也可制取CuCl
(1)在除杂过程中加Na2CO3溶液有两个作用:除去原溶液中的Ca2+及引入的Ba2+;
(2)电解食盐水:阳极:2Cl—2e-=Cl2↑;阴极:2H+ +2e-=H2↑;总反应式:2NaCl+2H2O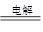 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑
(3)反应V中铜氧化为氧化铜,再与硫酸反应可得硫酸铜;
(4)由工艺流程可知,反应V消耗硫酸,而反应VI可产生硫酸;反应I消耗NaOH,而反应III电解食盐水过程中又可生产NaOH溶液。故在整个合成过程中可以循环利用的物质是硫酸和烧碱
(5)由于氯气氧化性强,与铜反应时时容易生成氯化铜
(6)结合题目所给信息,在真空机中可防止产品的氧化、70℃温度可加快乙醇和水的蒸发
本题难度:一般
| 