1、选择题 下列说法中错误的是( )。
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越弱
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
参考答案:AC
本题解析:SO2为角形(或V形)分子,因此SO2为极性分子,SO3为平面分子,SO3为非极性分子,A错误;NH4+中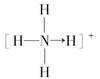 存在N→H配位键,Cu2+与NH3之间以配位键形成,B正确;电负性为原子吸引电子的能力大小,电负性越大的原子,吸引电子的能力越强;原子晶体的构成微粒为原子,原子之间以共价键结合,因此原子晶体的键能大熔点高、硬度大。
存在N→H配位键,Cu2+与NH3之间以配位键形成,B正确;电负性为原子吸引电子的能力大小,电负性越大的原子,吸引电子的能力越强;原子晶体的构成微粒为原子,原子之间以共价键结合,因此原子晶体的键能大熔点高、硬度大。
本题难度:一般
2、选择题 可以用来鉴别乙烷和乙烯,?又可以用来除去乙烷中混有的少量乙烯的操作方法是
A.混合气通过盛酸性高锰酸钾溶液的洗气瓶
B.混合气通过盛足量溴水的洗气瓶
C.混合气通过盛水的洗气瓶
D.混合气跟氯化氢混合
参考答案:B
本题解析:乙烯中含有碳碳双键,既能被酸性高锰酸钾溶液氧化,也能和溴水发生加成反应。但由于酸性高锰酸钾溶液能把乙烯氧化生成CO2气体,从而又引入新的杂质,所以除去乙烷中的乙烯应该用溴水。答案选B。
本题难度:简单
3、选择题 下列离子中外层d轨道达全充满状态的是 (? ? )
? )
A? Cu+?B? Fe3+?C? Co3+?D? Cr3+ ?
参考答案:A
本题解析:略
本题难度:一般
4、选择题 能表明非金属甲的非金属性比非金属乙的非金属性强的叙述正确的是:
A.在氧化还原反应中,甲得电子比乙得电子多
B.甲的最高价氧化物对应水化物酸性比乙的的最高价氧化物对应水化物酸性强
C.甲的氢化物水溶液酸性比乙的氢化物水溶液酸性强
D.向含甲和乙的阴离子的钠盐混合溶液中通入氯气,乙的阴离子先反应
参考答案:BD
本题解析:非金属性的比较规律:
1、由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。
2、由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。
3、由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。
4、由和氢气化合的难易程度判断:化合越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)
6、由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。
7、由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕
值得注意的是:氟元素没有正价态,故没有氟的含氧酸,所以最高价氧化物对应水合物的酸性最强的是高氯酸,而不是非金属性高于氯的氟元素!故规律5只适用于氟元素之外的非金属元素。
8、按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。
据此可知选项BD正确,答案选BD。
本题难度:一般
5、填空题 (8分)A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。C原子最外层电子数是核外电子层数的3倍,A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素;F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的价电子排布式?。
(2) B和C比较,第一电离能较大的是?(填元素符号),其原因为?。
(3)甲、乙两分子的中心原子的杂化类型是否相同?(相同、不相同)。
(4)已知化合物丁熔点190℃,沸点183℃。丙和丁比较,熔点较高的是?(填化学式),
(5)配合物戊由G3+与甲、元素F构成,已知该配合物的配位数为6。在含有0.1mol戊的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀。,则戊的化学式为?。
参考答案:(1)3d54s1 (2)N;N 原子价电子为2s22p3,2p轨道半充满,能量较低,难失1个电子,O原子价电子为2s22p4,易失1个电子;(3)相同;(4)NaCl;(5)[Cr(H2O)5Cl]Cl2
本题解析:根据题意可推出:A是H;B是N;C是O;D是Na;E是Al;F是Cl;G是Cr。甲是H2O;乙是H2O2;丙是NaCl;丁是AlCl3.(2)24号元素Cr基态原子的价电子排布式3d54s1;(2)一般情况下,同一周期的元素,元素的非金属性越强,其第一电离能越大,但是由于N原子核外的2p轨道上的电子处于半充满的稳定状态,能量较低,所以失去电子较难,因此N和O比较,第一电离能较大的是N;(3)在H2O和H2O2两分子的中心原子O的杂化类型是相同的,都是sp3杂化。(4)NaCl是离子晶体;而AlCl3.是分子晶体,分子晶体中分子之间通过分子间作用力结合,而离子晶体中离子之间通过离子键结合,离子键是一种强烈的相互作用,断裂较难,因此熔点较高的是NaCl。(5)在0.1mol戊电离产生的Cl-的物质的量为:n(Cl-)="n(AgCl)=" 28.7g÷143. 5g/mol=0.2mol,因此在一个戊的外围含有2个Cl-.由于配合物戊由Cr3+与甲、元素F构成,已知该配合物的配位数为6。所以在其络离子中含有一个Cl-.其余的是水分子。因此根据化合物中正负化合价的代数和为0的原则,可知该络合物的化学式是[Cr(H2O)5Cl]Cl2。
本题难度:一般