1、选择题 下列有关物质性质的比较中,正确的是(?)
①沸点:H2O>HCl>HF? ?②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4 ?④离子半径:O2->F->Na+
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:氟化氢分子间存在氢键,沸点高于氯化氢的,①不正确,沸点:H2O >HF>HCl;非金属性越强,最高价氧化物的水化物的酸性越强,③不正确,酸性:H3PO4<H2SO4<HClO4;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,④正确,答案选B。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:简单
2、选择题 下列结构示意图所代表的微粒属于阴离子的是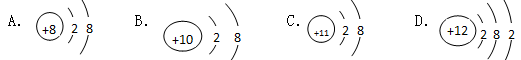
参考答案:A
本题解析:核外电子数大于质子数即为阴离子,符合条件的只有A,BD是原子,C 是阳离子,故选A
本题难度:简单
3、选择题 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪种原子不能产生NMR现象
A.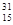 P
P
B.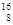 O
O
C.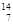 N
N
D. C
C
参考答案:B
本题解析:根据相对原子质量=质子数+中子数,及题意只有质子数或中子数为奇数的原子核有NMR现象,进行解答。
B项:根据相对原子质量=质子数+中子数,可知氮元素的质子数为8;中子数为:16-8=8,质子数或中子数为偶数,故错。故选B。
点评:本题考查学生根据相对原子质量与质子数、中子数的关系,依据题意进行分析解题的能力,要求思维灵活。
本题难度:简单
4、实验题 有短周期元素A、B、C、D、E,已知:?
①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜
 ② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
③ E与A同周期,C、D、E三种元素形成的单质或化合物可发生如下图所示的反应。
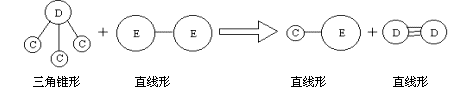
请用化学式或相应的符号回答下列问题:?
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式???;
(2)B元素在元素周期表第?周期第?族;
B的固态氧化物的晶体类型是?;
(3)D元素的原子结构示意图是:?;
(4)B元素与E元素的最高价氧化物的水化物的酸性强弱?>?;
(5)请用化学方程式表示E元素的单质在工业上的一种重要用途:?。
参考答案:(1)Al2O3+2OH-===2AlO2-+H2O(2分)
(2)3(1分),ⅣA(1分);原子晶体(2分)?
(3)?(2分)(4)HClO4>H4SiO4(或H2SiO3)(2分)
(5)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O(2分)
本题解析:略
本题难度:一般
5、选择题 下列说法不正确的是()
A.同族元素,随着核外电子层数的增加,I1逐渐增大
B.通常情况下,对于同一种元素的原子,其电离能I1<I2<I3
C.同周期元素,总体变化趋势是随着核电荷数的增加,I1增大
D.通常情况下,电离 能越小,元素的金属性越强
参考答案:A
本题解析:同族元素,随着核外电子层数的增加,I1逐渐减小,故A错误,为本题的正确答案;通常情况下,对于同一种元素的原子,其电离能I1<I2<I3,故B正确;同周期元素,总体变化趋势是随着核电荷数的增加,I1增大,故C正确;通常情况下,电离能越小,元素的金属性越强,故D正确。
点评:本题考查了元素周期律的知识点,该知识点是高考考查的重点和热点,本题属于对基础知识的考查,本题比较容易。
本题难度:简单