| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《化学平衡》高频考点强化练习(2020年最新版)(三)
3、选择题 如下图所示,图I是恒压密闭容器,图II是恒容密闭容器。当其它条件相同时,在I、II中分别加入2?mol?X和2?mol?Y,开始时容器的体积均为VL,发生如下反应并达到平衡状态: 4、填空题 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 5、简答题 (14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1 CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1 2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1 反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的△H= ; 2CO(g)+2H2(g) 的△H= ;③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ; 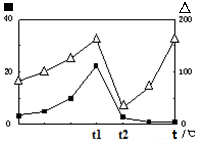 (?代表CO的生成速率,■代表催化剂的催化效率) (?代表CO的生成速率,■代表催化剂的催化效率)④为了提高该反应中CH4的转化率,可以采取的措施是 ; ⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。 (2)以CO2为原料可以合成多种物质。 ①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ; ②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《铝》高频试.. | |