|
高中化学必备知识点《化学平衡》高频考点强化练习(2020年最新版)(四)
2021-06-11 06:15:50
【 大 中 小】
|
1、选择题 碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应: 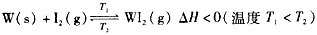 下列说法正确的是 下列说法正确的是
[? ]
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是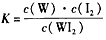
D.利用该反应原理可以提纯钨
参考答案:AD
本题解析:
本题难度:一般
2、选择题 下列事实不能用勒夏特例原理解释的是
A.红棕色的NO2加压后颜色先变深后变浅
B.实验室中常用排饱和食盐水的方法收集氯气
C.合成氨气反应 N2 + 3H2 = 2NH3(正反应放热)中使用催化剂
D.SO2催化氧化成SO3的反应,使用过量空气以提高二氧化硫的转化率
|
参考答案:C
本题解析:本题考查外界条件(温度、压强、浓度)对化学平衡的影响,而催化剂只会改变反应的速率,而不影响化学平衡。A项加压平衡发生移动;B项饱和食盐水中存在溶解平衡,所以氯气在该溶液中的溶解度小,用于收集氯气;D项使用过量的空气,增大氧气的浓度,平衡向正反应方向移动,提高二氧化硫的转化率。
考点:勒夏特列原理。
本题难度:一般
3、选择题 如下图所示,图I是恒压密闭容器,图II是恒容密闭容器。当其它条件相同时,在I、II中分别加入2?mol?X和2?mol?Y,开始时容器的体积均为VL,发生如下反应并达到平衡状态:
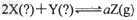 ,此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是 ,此时I中X、Y、Z的物质的量之比为1:3:2。下列判断正确的是
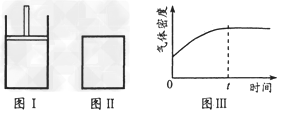
[? ]
A.?物质Z的化学计量数a=2
B.?若II中气体的密度如图III所示,则X、Y均为气态
C.?若X、Y均为气态,则在平衡时X的转化率:I?>II
D.?若X为固态、Y为气态,则I、II中从开始到平衡所需的时间:I〉II
参考答案:C
本题解析:
本题难度:一般
4、填空题 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+O2(g)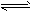 2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物 2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物
O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时SO2转化率为_________。
?(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)_______________。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是__________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为_____________。
参考答案:(1)0.1 mol/(L·min);20%
(2)ABE
(3)AD
(4)80%
本题解析:
本题难度:一般
5、简答题 (14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表: 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质
| CH4
| CO2
| CO
| H2
| 体积分数
| 0.1
| 0.1
| 0.4
| 0.4
|
①此温度下该反应的平衡常数K= 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H= ; 2CO(g)+2H2(g) 的△H= ;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ;
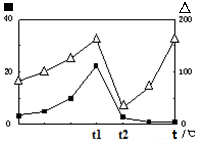 (?代表CO的生成速率,■代表催化剂的催化效率) (?代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
参考答案:(共14分,每空2分)(1)①64 ②+1379.3 kJ·mol-1
(2)①温度超过250℃时,催化剂的催化效率降低 ②(扩体)减小压强或增大CO2的浓度 ③逆反应
(3)①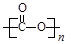 ②CO2+8e-+6H2O=CH4+8OH- ②CO2+8e-+6H2O=CH4+8OH-
本题解析:(1)① CO2(g)+CH4(g) 2CO(g)+2H2(g) 2CO(g)+2H2(g)
起始(mol) 6 6 0 0
反应(mol) X X 2X 2X
平衡(mol) 6-X 6-X 2X 2X
由CH4的体积分数为0.1,则 =0.1,解得X=4,所以K= =0.1,解得X=4,所以K= =64; =64;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g) 2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1; 2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1;
③温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
④正反应是体积减小的可逆反应,降低压强、增大CO2的浓度,平衡正向移动,反应物转化率增大;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则此时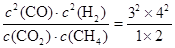 =72>64,所以上述平衡向逆反应方向移动。 =72>64,所以上述平衡向逆反应方向移动。
(2)①CO2的结构式为O=C=O,发生加聚反应得到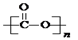 ; ;
②原电池中负极失去电子,正极得到电子,因此CO2在正极发生还原反应转化为甲烷,电极反应为:CO2+8e-+6H2O=CH4+8OH-。
考点:考查化学反应常数、化学平衡以及原电池原理的运用
本题难度:一般
|  2CO(g)+2H2(g) 的△H= ;
2CO(g)+2H2(g) 的△H= ; (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)