1、简答题 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下:
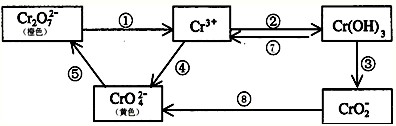
回答下列问题:
(1)上述转化关系中属于氧化还原反应的是______(填编号),其中需要使用氧化剂的是______(填编号).
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______.
(3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:______.
(4)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水.写出电极反应和溶液中进行的反应的离子方程式.阳极______ 阴极______溶液中______.
(5)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______.
参考答案:(1)上述几步转化中,①中Cr元素的化合价降低,④⑧中Cr元素的化合价升高,则①④⑧属于氧化还原反应,且④⑧中需要加入氧化剂,
故答案为:①④⑧;④⑧;
(2)由Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色及转化⑤可知,发生的离子反应为2CrO42-+2H+

?Cr2O72-+H2O,
故答案为:2CrO42-+2H+

?Cr2O72-+H2O;?
(3)转化图中只有氢氧化铬与氢氧化铝类似,则氢氧化铬具有两性,能与碱反应,离子反应为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;?
(4)铁作阳极,则阳极反应为Fe-2e=Fe2+,溶液中的阳离子H+在阴极放电,则阴极反应为H++2e=H2↑,电解产生的亚铁离子具有还原性,与
Cr2O72-发生氧化还原反应,Cr2O72-转化为Cr3+,则溶液中发生的离子反应为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:Fe-2e=Fe2+;H++2e=H2↑;6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O; ?
(5)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,
设Na2CrO4和NaCl的浓度都为1mol/L,
Ag2CrO4沉淀时需要的c(Ag+)=
本题解析:
本题难度:一般
2、选择题 溴的氧化性介于氯和碘的氧化性之间,利用这一性质解决下面的问题.你认为:将下列哪种试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2( )
A.I2
B.I-
C.Cl2
D.Cl-
参考答案:溴的氧化性介于氯和碘的氧化性之间,即氧化性:Cl2>Br2>I2,则
A.氧化性:Br2>I2,I2不能氧化Br-生成Br2,故A错误;
B.I-只具有还原性,不能氧化Br-生成Br2,故B错误;
C.氧化性:Cl2>Br2,将Cl2通入含有Br-的溶液中可以将Br-氧化为Br2,故C正确;
D.Cl-只具有还原性,不能氧化Br-生成Br2,故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 下列反应中,既是化合反应,又是氧化还原反应的是( )
(1)铁和氯气反应:2Fe+3Cl2═2FeCl3
(2)氯气通入溴化钠溶液:Cl2+2NaBr═2NaCl+Br2
(3)氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)═Na2SO4+2HCl↑
(4)二氧化锰跟浓盐酸在加热条件下反应:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
(5)氢气在氯气中燃烧:H2+Cl2═2HCl.
A.(1)(2)
B.(1)(3)
C.(1)(4)
D.(1)(5)
参考答案:(1)铁和氯气反应:2Fe+3Cl2═2FeCl3中铁元素、氯元素的化合价都发生变化,所以是氧化还原反应,且是由两种物质生成一种物质,所以也是化合反应;
(2)氯气通入溴化钠溶液:Cl2+2NaBr═2NaCl+Br2中氯元素、溴元素的化合价都发生变化,所以是氧化还原反应,同时属于置换反应;
(3)氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)═Na2SO4+2HCl↑中,各元素化合价都不变,所以不是氧化还原反应,属于复分解反应;
(4)二氧化锰跟浓盐酸在加热条件下反应:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O中氯元素、锰元素化合价都发生变化,所以是氧化还原反应,但不是化合反应;
(5)氢气在氯气中燃烧:H2+Cl2═2HCl中氢元素和氯元素化合价都发生变化,所以是氧化还原反应,且属于化合反应;
故选D.
本题解析:
本题难度:简单
4、选择题 必须加入氧化剂后才能发生的变化是( )
A.Cl2→Cl-
B.Cl-→Cl2
C.Cu2+→Cu
D.CO32-→CO2
参考答案:A.Cl2→Cl-化合价降低,应加入还原剂才能实现,故A不选,
B.Cl-→Cl2化合价升高,需加入氧化剂才能实现,故B选;
C.Cu2+→Cu化合价降低,应加入还原剂才能实现,故C不选;
D.CO32-→CO2化合价没有发生变化,不是氧化还原反应,故D不选.
故选B.
本题解析:
本题难度:一般
5、简答题 (1)在S+2KNO3+3C=K2S+N2+3CO2的反应中______元素被氧化,______元素被还原;______是氧化剂,______是还原剂;______是氧化产物,______是还原产物.
(2)某物质A在一定条件下加热分解,产物都是气体,分解方程式为:
2A(s)=B(g)+2C(g)+2D(g),取一定量的A加热,完全分解,同温同压下测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为______.
(3)现有A、B、C、D四瓶溶液,它们分别是NaCl(0.1mol?L-1)、HCl(0.1mol?L-1)、NaOH(0.1mol?L-1)和酚酞试液(0.1%)中的一种.有人不用其他试剂,就可以把它们一一鉴别开来,其实验步骤如下:
①各取溶液少许两两混合,据现象不同分成两组;
②取一组混合液,不断滴入另一组的一种未知溶液,根据现象不同可鉴别出A和B两种溶液;
③再取已鉴别出A溶液2mL,滴入3滴未知C溶液,再加入D溶液4mL,在这个过程中无明显颜色变化;
综合以上实验可知,A、B、C、D溶液分别是:
A______;?B______;?C______;?D______.
参考答案:解(1)在反应2KNO3+3C+S=K2S+N2↑+3CO2↑中,N元素的化合价由+5降低为0,S元素的化合价由0降低为-2价,则KNO3和S作氧化剂,被还原的元素为N、S,K2S、N2是还原产物,C元素的化合价由0升高到+4,则C作还原剂,被氧化,对应的CO2为氧化产物,故答案为:C,S、N,S、KNO3,C,CO2,K2S、N2;
(2)相同条件下,气体的相对分子质量和气体的密度成正比,所以三种气体的平均相对分子质量为2d,右边相对分子质量总和为5×d=10d,根据质量守恒定律,左边2A的质量也是10d,所以,A的相对分子质量为5d,
故答案为:5d;
(3)盐酸和氯化钠遇酚酞颜色不变,氢氧化钠遇酚酞变为蓝色,所以分为两组是:盐酸和氯化钠一组,氢氧化钠和酚酞一组,氢氧化钠和酚酞的显红色的溶液中,加入盐酸时,颜色会从红色变为无色,加氯化钠时溶液的颜色不变,所以可以先鉴别出A是盐酸,B是氯化钠,向盐酸中加入酚酞时,溶液无色,再加入氢氧化钠时,溶液会从无色变为红色,在这个过程中有明显颜色变化,所以C是氢氧化钠,D是酚酞,
故答案为:HCl;NaCl;NaOH;酚酞.
本题解析:
本题难度:一般