1、填空题 已知某反应中反应物与生成物有:HNO3、Cu(NO3)2、NO、Cu、H2O
(1)已知Cu在反应中失去电子,则该反应的氧化剂是______.
(2)该反应中,发生还原反应的过程是(写化学式)______→______.
(3)将反应物的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)如有1.5mol?Cu参加反应,有______mol?HNO3参加反应,被还原的HNO3的物质的量是______mol.转移电子的物质的量是______?mol.
参考答案:(1)Cu在反应中失去电子,所以金属铜是还原剂,HNO3中的N元素处于最高价,所以硝酸具有氧化性,做氧化剂,故答案为:HNO3;
(2)该反应是金属铜和硝酸的反应,化合价降低的N元素发生还原反应,即从硝酸的+5价氮元素降为NO中的+2价氮元素,故答案为:HNO3→NO;
(3)该反应是金属铜和硝酸的反应,根据电子守恒来配平化学方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,电子转移的方向和数目如下所示:
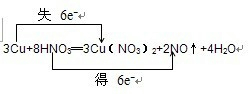
,或

,故答案为:

;
(4)根据化学方程式可以看出:当有3mol金属铜参加反应时,就有8mol的硝酸参与反应,转移电子为6mol,所以当有1.5mol金属铜参加反应时,就有4mol的硝酸参与反应,被还原的HNO3的物质的量是参加反应硝酸物质的量的四分之一,即被还原的HNO3的物质的量是1mol,转移电子为3mol,故答案为:4;1;3.
本题解析:
本题难度:一般
2、选择题 下列说法不正确的是( )
A.Na2O2、HClO、SO2等物质都具有漂白作用
B.液氨、液氯、液态氯化氢都是电解质
C.所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应
D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应
参考答案:A.Na2O2、HClO具有强氧化性,能氧化有色物质,具有漂白性,SO2能和品红形成无色物质,SO2能漂白品红,所以Na2O2、HClO、SO2都具有漂白作用,故A正确;
B.液氨在水中不能自身电离,是非电解质;液氯是单质,它既不是电解质也不是非电解质;液态氯化氢是电解质,故B错误;
C.由于置换反应前后元素化合价一定发生了变化,所以置换反应一定是氧化还原反应;复分解反应前后元素化合价一定没变,所以复分解反应一定不是氧化还原反应,故C正确;
D.非金属氧化物不一定是酸性氧化物,可能是不成盐氧化物,如CO属于非金属氧化物但不属于酸性氧化物,金属氧化物不一定是碱性氧化物,如:Mn2O7是酸性氧化物,Al2O3,是两性氧化物,故D正确;
故选B.
本题解析:
本题难度:一般
3、选择题 在用浓盐酸与Mn02共热制取Cl2的反应中,消耗二氧化锰的物质的量与作为还原剂的氯化氢的物质的量之比是( )
A.1:1
B.1:2
C.1:4
D.2:l
参考答案:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O中,锰元素化合价由+4价→+2价,1mol二氧化锰失去2mol电子,
氯化氢中氯元素的化合价由-1价→0价,1mol作还原剂的氯化氢失去1mol电子,要使得失电子数相等,则氧化剂和还原剂的计量数之比是1:2,
故选B.
本题解析:
本题难度:简单
4、选择题 下列反应中盐酸既表现出酸性有表现出氧化性的是( )
A.MnO2+4HCl(浓)
MnCl2+Cl2↑+H2O
B.HCl+AgNO3=AgCl↓+HNO3
C.Zn+2HCl=ZnCl2+H2↑
D.2HClH2↑+Cl2↑
参考答案:A.反应中Cl化合价升高,被氧化,盐酸表现出还原性,故A错误;
B.反应为复分解反应,化合价没有变化,不是氧化还原反应,故B错误;
C.生成氢气,盐酸表现出氧化性,生成氯化锌,盐酸表现出酸性,故C正确;
D.分解时H盐酸的化合价降低,Cl元素的化合价升高,盐酸既表现出氧化性,又表现出还原性,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列物质溶解于水,水的作用与其它三个反应不同的是( )
A.NO2溶解于水
B.Na溶解于水
C.Na2O2溶解于水
D.Cl2溶解于水
参考答案:B
本题解析:
本题难度:简单