1、选择题 下列反应属于放热反应的是( ?)
A.液态水气化
B.将胆矾加热变为白色粉末
C.浓硫酸稀释
D.氧化钙溶于水
参考答案:D
本题解析:常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应、绝大多数化合反应、置换反应、少数分解、复分解反应,A和C是物理变化,B是吸热反应。
本题难度:一般
2、填空题 (6分)下列反应中,属于放热反应的是?,属于吸热反应的是?
①食物在空气中腐败?②生石灰与水作用制熟石灰?③碳和二氧化碳化合生成CO ④酸与碱中和反应?⑤加热KClO3和MnO2的混合物制O2⑥将氯化铵晶体和氢氧化钡晶体混合均匀放在日光下暴晒
参考答案:①②④;③⑤⑥(每空3分,多选不给分,漏选得1分)
本题解析:略
本题难度:一般
3、选择题 下列说法中正确的是
A.吸热反应在不加热的条件下一定不能发生
B.放热反应在常温下一定很容易发生
C.由“C(石墨)= C(金刚石);△H=" +119" kJ/mol ”知石墨比金刚石稳定
D.化学反应中的能量变化,只表现为热能的变化
参考答案:C
本题解析:A 错误,吸热反应在不加热的条件下也可能发生,例如硝酸铵和氢氧化钡反应在常温下就反应,且为吸热反应。
B 错误,放热反应在常温下也不一定很容易发生,例如,煤的燃烧
C 正确,能量越低越稳定,石墨的能量比金刚石的低,故石墨稳定。
D 错误,化学反应中的能量变化,大多表现为热能的变化,有时也存在电能等的转化,例如原电池。
本题难度:一般
4、简答题 (7分)(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s);△H =" -235.8" kJ/mol;?
己知:2 Ag2O(s)===4Ag(s)+O2(g);△H = +62.2kJ/mol;
则反应 2O3(g)= 3O2(g)?的△H = ?kJ/mol;
②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产?
生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为?。
 (2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)?某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
(2)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)?某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃) 条件下反应,反应进行到不同时间测得各物质的浓度如下:
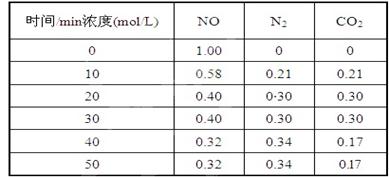
①在10 min~20 min的时间段内,以CO2表示的反应速率为??;
②写出该反应的平衡常数的表达式K=?;
③下列各项能作为判断该反应达到平衡状态的是??(填序号字母);
A.容器内压强保持不变
B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变