1、填空题 有关元素X、Y、Z、D、E的信息如下
| 元素 | 有关信息
X
元素主要化合价为-2,原子半径为0.074nm
Y
所有主族序数与所在周期序数之差为4
Z
原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰
D
最高价氧化物既能溶于强酸又能溶于强碱
E
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏
|
用化学用语答下列问题:
(1)E在元素周期表中的位置为______;Z的氢化物电子式为______
(2)沸点:硒化氢______X的氢化物(填“>”或“<”).
X、Y、D形成的简单离子的半径由大到小为______.
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为______,D的最高价氧化物溶于强碱的离子方程式为______.
(4)E元素与Y元素可形成EY2和?EY3两种化合物,下列说法正确的是(填序号)______.
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、E2Y3均能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④向煮沸的NaoH溶液中滴加几滴饱和EY3溶液,可以制得胶体
(5)右图所示物质均为常见化合物,其中甲为上述五种元素中的两种组成,乙在常温下为液态,工业上常用电解戊冶炼金属,则甲与乙发生反应的化学方程式______.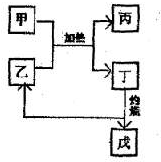
参考答案:X元素主要化合价为-2,原子半径为0.074nm,则X处于第ⅥA族;Z原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,则Z为S元素,X为O元素;D最高价氧化物既能溶于强酸又能溶于强碱,则D为Al元素;
E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe元素;Y所在主族序数与所在周期序数之差为4,满足该条件元素为O或Cl,由于X为O元素,则Y为Cl元素.
即X为O元素,Y为Cl元素,Z为S元素,D为Al元素,E为Fe元素.
(1)E为Fe元素,处于元素周期表第四周期第Ⅷ族;Z为S元素,氢化物为H2S,属于共价化合物,硫原子与氢原子之间形成1对共用电子对,电子式为
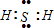
.
故答案为:第四周期第Ⅷ族;
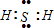
.
(2)X为O元素,其氢化物为H2O,常温为液态,氧元素电负性很强,水分子之间存在氢键,所以沸点硒化氢<H2O.
故答案为:<.
X、Y、D形成的简单离子分别为O2-、Cl-、Al3+.O2-、Al3+离子的核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径O2->Al3+,Cl-、O2-的最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->O2-,所以离子半径Cl->O2->Al3+.
故答案为:<;Cl->O2->Al3+.
(3)X为O元素,X的一种氢化物可用于实验室制取X的单质,则为过氧化氢分解制取氧气,反应方程式为
2H2O2?MnO2?.?2H2O+O2↑;D的最高价氧化物为Al2O3,溶于强碱生成偏铝酸根离子和水,
离子方程式为Al2O3+2OH-=2AlO2-+H2O.
故答案为:2H2O2?MnO2?.?2H2O+O2↑;Al2O3+2OH-=2AlO2-+H2O.
(4)E元素与Y元素可形成EY2和?EY3两种化合物为FeCl2、FeCl3.
①FeCl2易被氧气氧化,保存FeCl2溶液时,需向溶液加入少量Fe单质,故①正确;
②FeCl2可通过FeCl3与Fe化合得到,FeCl3可由铁与氯气化合得到,故②正确;
③铜片、碳棒和FeCl3溶液组成原电池,铜发生氧化反应,为负极,电子由铜片沿导线流向碳棒,故③正确;
④向煮沸的NaoH溶液中滴加几滴饱和FeCl3溶液,得到氢氧化铁沉淀,不能得到氢氧化铁胶体,故④错误.
故选:①②③.
(5)甲为上述五种元素中的两种组成,乙在常温下为液态,则乙为水,工业上常用电解戊冶炼金属,戊为氧化铝,所以丁为氢氧化铝,故甲为铝盐,故为氯化铝.则甲与乙发生反应的化学方程式 AlCl3+3H2O?△?.?Al(OH)3+3HCl↑.
故答案为:AlCl3+3H2O?△?.?Al(OH)3+3HCl↑.
本题解析:
本题难度:一般
2、填空题 (共6分)A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):
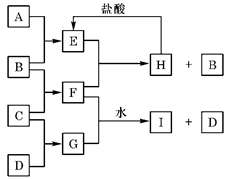
(1)A是?,C是?。
(2)H与盐酸反应生成E的化学方程式是?。
(3)E与F反应的化学方程式是
?。
(4)F与G的水溶液反应生成I和D的离子方程式是?。
参考答案:(1)碳、钠
(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(3)2CO2+2Na2O2=2Na2CO3+O2
(4)Na2O2+S2-+2H2O=4OH-+S↓+2Na+
本题解析:略
本题难度:简单
3、推断题 物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。

请回答下列问题:
(1)写出下列物质的化学式:B________、E________、G?________;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是________,阴极物质是______,电解质溶液是_____________;
(3)反应②的化学方程式是__________________________________;
(4)将0.23?mol?B和0.11?mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12?mol?D,则反应的平衡常数K=________。若温度不变,再加入?0.50?mol氧气后重新达到平衡,则B的平衡浓度________(填“增大”、 “不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”),D的体积分数________(填“增大”、“不变”或“减小”)。
参考答案:(1)SO2;H2SO4;Cu2O
(2)粗铜;精铜;CuSO4溶液
(3)?Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)?23.8L/mol;减小;降低;减小
本题解析:
本题难度:一般
4、填空题 下列框图中的A-G是中学化学中常见的七种物质,已知常温、常压下D为无色液体,C、E为气态单质,B为金属单质,其它为化合物,A、G、F焰色反应都显黄色.A-G可发生如下转化:
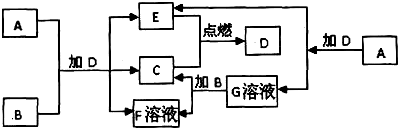
请填写下列空白:
(1)A的化学式为______,金属B原子结构示意图为______.
(2)写出B与G溶液反应的化学方程式______;若81gB与足量的G溶液完全反应,则转移的电子的物质的量为______;
(3)向F的水溶液中通入足量的CO2气体,其离子方程式为______.
参考答案:框图中的A-G是中学化学中常见的七种物质,C、E为气态单质,二者在点燃条件下生成常温、常压下D为无色液体,则D为H2O,C、E分别为H2、O2中的一种,化合物A、G、F焰色反应都显黄色,均含有Na元素,A与水反应生成生成E与G,故A为Na2O2,E为O2,G为NaOH,可推知C为H2,金属B与NaOH溶液反应生成氢气与F溶液,则B为Al,F为NaAlO2,过氧化钠与Al加水,可以得到氢气、氧气与偏铝酸钠,
(1)由上述分析可知,A为Na2O2,B为Al,原子核外有3个电子层,各层电子数为2、8、3,其原子结构示意图为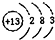 ,
,
故答案为:Na2O2;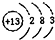 ;
;
(2)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的化学方程式为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑,81gAl的物质的量=81g27g/mol=3mol,与足量的NaOH溶液完全反应,则转移的电子的物质的量为3mol×3=9mol,
故答案为:2NaOH+2Al+2H2O═2NaAlO2+3H2↑;9mol;
(3)向NaAlO2的水溶液中通入足量的CO2气体,反应生成氢氧化铝沉淀与碳酸氢钠,其离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
本题解析:
本题难度:一般
5、填空题 A+、B+、C-、D、E?五种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++C-→D+E;②B++C-→2D.据此,回答下列问题:
(1)写出①反应的离子方程式______.
(2)E和A+的电子式E______、A+______.
参考答案:常见的10电子分子有:CH4、NH3、H2O、HF、Ne,离子有:H3O+、OH-、NH4+、F-、Na+、Mg2+、Al3+等,B++C-→2D可知B+为H3O+,C-为OH-,D为H2O;由A++C-→D+E可知A+为NH4+,E为NH3,则
(1)反应①为NH4+和OH-的反应,生成H2O和NH3,反应的离子方程式为,故答案为:NH4++OH-=NH3 +H2O;
(2)E为NH3,为共价化合物,电子式为
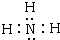
,A+为NH4+,电子式为
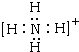
,
故答案为:
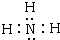
;
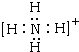
.
本题解析:
本题难度:一般