1、选择题 向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是? (? )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:若醋酸与氢氧化钾等体积混合,两者恰好完全反应生成醋酸钠和水;此时溶液中粒子关系为,电荷守恒:c(K+)+c(H+)=c(OH-)+c(CH3COO-),质量守恒:c(CH3COOH)+c(CH3COO-)=c(K+),质子守恒:c(OH-)= c(H+) +c(CH3COOH);所以
A正确,Va>Vb时:醋酸过量,即有c(CH3COOH)+c(CH3COO-)>c(K+);B正确,Va=Vb时:由质子守恒得c(CH3COOH)+c(H+)=c(OH-);C错,Va<Vb时:KOH过量,c(K+)>c(CH3COO-)>c(OH-)>c(H+);D正确,由电荷守恒可得,任意溶液中c(K+)+c(H+)=c(OH-)+c(CH3COO-);
本题难度:一般
2、简答题 根据Fe3++ Ag  ?Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
?Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是?(用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是?(填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化。他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不?可行,乙同学的理由是?。
(4)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:
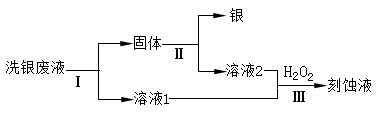
①过程Ⅰ中反应的离子方程式是?。
②过程Ⅱ中加入的试剂可以是?。
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是?。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为?g。
参考答案:(1)Fe3++3H2O  ?Fe(OH)3+3H+?(2)a
?Fe(OH)3+3H+?(2)a
(3)酸性条件下NO3-也可能与Fe2+发生氧化还原反应?(4)①2Fe3++Fe=3Fe2+?Fe+2Ag+=Fe2++2Ag
②稀盐酸或稀硫酸?(5)①Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O?②10.8
本题解析:(1)FeCl3溶液显酸性是因为铁离子水解生成氢氧化铁和氢离子;反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+;(2)FeCl3溶液洗银,发生反应为:Fe3++Ag?Fe2++Ag+;a.c(Fe3+)减小 故a符合;b. c(Cl-)不变,故b不符合;c.铁元素存在形式不同但质量不会减小,故c不符合;(3)可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化;同时注意在酸溶液中,亚铁离子也会反应;(4)①洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液需要先加入过量铁,还原Fe3+、Ag+;反应的离子方程式为:2Fe3++Fe=3Fe2+Fe+2Ag+=Fe2++2Ag;②过程Ⅱ中加入的试剂是溶解过量的铁,可以用稀盐酸或稀硫酸;(5)①银氨溶液中加入过量盐酸生成氯化银,同时生成氯化铵和水,反应的化学方程式为:Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O;②向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.反应为:2AgCl+2NH2OH=N2↑+2Ag+2H2O+2HCl,反应中消耗3.3g羟氨物质的量= =0.1mol,生成银的物质的量0.1mol,质量10.8g。
=0.1mol,生成银的物质的量0.1mol,质量10.8g。
本题难度:困难
3、选择题 常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-)
D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:D
本题解析:A、从化学式中各离子关系分出大小,相同在考虑水解和电离平衡,0.1 mol·L-1 (NH4)2Fe(SO4)2溶液关系为 c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),错误;B、电荷守恒式应为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),错误;C、质子守恒为c(H+)+c(H2CO3)=c(OH-)+c(CO32-),错误;D、酸过量,溶液为醋酸钠和醋酸混合液,以醋酸电离为主,故有c (CH3COO-)>c (Na+)>c (H+)>c (OH-),正确。
本题难度:一般
4、选择题 已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
A.NaHB属于弱电解质
B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-]
C.[Na+]=[HB-]+[B2-]+[H2B]
D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O
参考答案:C
本题解析:NaHB属于钠盐,是强电解质,A错误;NaHB可能存在水解大于电离,溶液显碱性,[OH-]>[H+],B项只是可能正确;C项是物料守恒,正确;D项应为HB-+OH-=B2-+H2O。
本题难度:一般
5、选择题 35℃时,在0.1mol·L-1的Na2S,NaHS两溶液中均存在的关系是(? ).
A? c(OH-)×c(H+)=1×10-14
B? c(Na+)=c(S2-)+c(HS-)+c(H2S)
C? c(OH-)=c(H+)+c(HS-)+2c(H2S)
D? c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
参考答案:D
本题解析:在溶液中,c(OH-)×c(H+)=kw 35℃时,c(OH-)×c(H+)>1×10-14 在0.1mol·L-1的Na2S溶液中
物料守恒:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S)
在0.1mol·L-1的NaHS溶液中
物料守恒:c(Na+)=c(S2-)+c(HS-)+c(H2S)
电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
质子守恒:c(OH-)+c(S2-)=c(H+)+c(H2S)
综上分析,选(D)项.
本题难度:简单