1、选择题 下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.稀醋酸溶液加热时其pH 减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀
D.浓的硫化钠溶液有臭味
参考答案:B
本题解析:A.纯碱Na2CO3是强碱弱酸盐,水解使溶液显碱性。而油污属于酯,在碱性条件下水解得到高级脂肪酸钠与甘油等容易溶解于水的物质。因此纯碱溶液能够去油污。错误。B.醋酸是弱酸,,电离需要吸收热量。升高温度,促进醋酸的电离。使溶液的酸性增强,其pH 减小。但是这与盐类水解无关。正确。C.小苏打NaHCO3是强碱弱酸盐,水解使溶液显碱性;而AlCl3是强酸弱碱盐,水解使溶液酸性,二者混合,发生双水解反应产生CO2气体和Al(OH)3沉淀.与盐的水解有关。错误。D.浓的硫化钠是强碱弱酸盐,水解产生H2S。浓度大,水解产生H2S多,所以溶液会逸出H2S的臭鸡蛋的臭味。
本题难度:一般
2、选择题 向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
_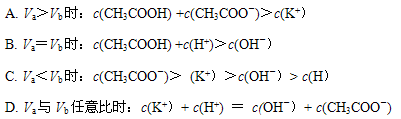
参考答案:BC
本题解析:Va=Vb时,醋酸与KOH恰好完全反应,溶质只有醋酸钾,溶液显碱性,根据质子守恒,得C(CH3COOH)+C(H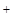 )=C(OH
)=C(OH ),B错。Va>Vb时,CH3COOH有剩余,根据物料守恒,得C(CH3COOH)+C(CH3COO-)>C(K+),A对。Va<Vb时,KOH有剩余,溶液显碱性,C(OH
),B错。Va>Vb时,CH3COOH有剩余,根据物料守恒,得C(CH3COOH)+C(CH3COO-)>C(K+),A对。Va<Vb时,KOH有剩余,溶液显碱性,C(OH )> C(H
)> C(H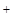 ),根据电荷守恒C(K+)+ C(H
),根据电荷守恒C(K+)+ C(H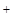 )= C(OH
)= C(OH )+ C(CH3COO-),可得C(CH3COO-)< C(K+),C错。Va与Vb任意比混合时,体系中的阴阳离子都只有K+?H
)+ C(CH3COO-),可得C(CH3COO-)< C(K+),C错。Va与Vb任意比混合时,体系中的阴阳离子都只有K+?H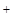 ?OH
?OH ?CH3COO-四种,遵循电荷守恒C(K+)+ C(H
?CH3COO-四种,遵循电荷守恒C(K+)+ C(H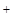 )= C(OH
)= C(OH )+ C(CH3COO-),D对。
)+ C(CH3COO-),D对。
本题难度:一般
3、填空题 (16分)物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.01mol/L的NH4Cl溶液中各种离子的浓度由大到小顺序为? ;电荷守恒关系:?;浓度为0.01mol/L的是?;?和?两种粒子的浓度之和是0.01mol/L。
(2 )CH3COONa溶液中存在的2个平衡体系分别为(分别用离子方程式表示):?、?;
(3) FeCl3溶液与Na2CO3溶液混合后,反应的离子方程式为??.
参考答案:(1)c(Cl-)>c(NH4+)>c(H+)>c(OH-) , c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) , Cl-, NH4+?NH3.H2O
(2)CH3COO-+H2O CH3COOH+OH-,? H2O
CH3COOH+OH-,? H2O H++OH-
H++OH-
(3)2Fe3++3CO32-=2Fe(OH)3↓+3CO2↑
本题解析:(1)氯化铵水解显酸性,但水解程度还是很弱的,所以离子的浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。满足电荷守恒的关系是c(H+)+ c(NH4+)= c(Cl-)+ c(OH-)。根据氮原子守恒可知NH4+和NH3.H2O两种粒子的浓度之和是0.01mol/L。因为氯离子不水解,所以氯离子的浓度也是0.01mol.L的。
(2)水溶液中一定有水的电离平衡。醋酸钠水解显碱性,所以还存在水解平衡。
(3)氯化铁水解显酸性,碳酸钠水解显碱性,所以二者的混合液水解相互促进,使水解完全,生成氢氧化铁沉淀,放出CO2气体。
本题难度:一般
4、填空题 (1)工业上用氨和二氧化碳反应合成尿素。已知下列物质在一定条件下均能与水反应产生 。H2是合成氨的原料,
。H2是合成氨的原料,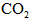 供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
A.CO B.石脑油(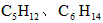 ) C.
) C.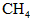 D.焦炭
D.焦炭
(2) 水解生成BiOCl沉淀.试回答下列问题:
水解生成BiOCl沉淀.试回答下列问题:
①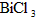 分解的反应方程式为____________________________________.
分解的反应方程式为____________________________________.
②医药上把BiOCl叫做交氯酸铋,分析这种名称是否合理:_______________.
③把适量的 溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
参考答案:(1)B
(2)①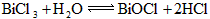 ;②不合理,因为BiOCl中,Cl的化合价为-1价;
;②不合理,因为BiOCl中,Cl的化合价为-1价;
③浓NaOH溶液中, 抑制
抑制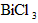 的溶解,使
的溶解,使 的浓度减小,盐酸中
的浓度减小,盐酸中 抑制
抑制 的水解
的水解
本题解析:
本题难度:一般
5、选择题 等体积的下列各溶液中,阴离子的总浓度最大的是( )
A.0.2mol·L-1Na2CO3溶液
B.0.1mol·L-1Ba(OH)2溶液
C.0.2mol·L-1CH3COOH溶液
D.0.2mol·L-1的氨水
参考答案:A
本题解析:0.2mol·L-1Na2CO3溶液,由于CO32-+H2O=HCO3-+OH-,所以阴离子的总浓度大于0.2mol·L-1。0.1mol·L-1Ba(OH)2溶液,阴离子的总浓度为0.2mol·L-1。0.2mol·L-1CH3COOH溶液,由于CH3COOH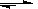 CH3COO-+H+,所以阴离子的总浓度小于0.2mol·L-1。0.2mol·L-1的氨水,由于NH3?H2O
CH3COO-+H+,所以阴离子的总浓度小于0.2mol·L-1。0.2mol·L-1的氨水,由于NH3?H2O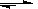 OH-+NH4+,所以阴离子的总浓度小于0.2mol·L-1。所以答案选A。
OH-+NH4+,所以阴离子的总浓度小于0.2mol·L-1。所以答案选A。
点评:这类试题,高考热点习题,在比较离子浓度大小时,要注意离子的水解和电离。
本题难度:一般