1、推断题 A、B、C、D、E、F、G七种元素的原子序数依次增大且不超过20。在周期表中A的原子半径最小;D是地壳中含量最大的元素,B、D的原子序数之比为 3:4,A和E、B和F同主族,A、D、E的原子序数之和等于G的原子序数,请回答:
(1)A与D形成的化合物固态时的晶体类型是____________ 。
(2)化合物BD2的结构式为___________,化合物GB2的电子式为_____________。
(3)C和F结合可生成一种超硬物质,有关该物质性质的叙述中不正确的是(填序号)___________。
①有润滑性②易磨损③抗腐蚀④强还原性⑤抗冷热
(4)F单质与NaOH溶液反应的离子方程式______________ 。
(5)将物质的量比为1:1的CO2和H2O组成的混合气体,通入到a mol的E2D2(固体过量)中,反应后的固体混合物加入到500 mL 1 mol·L-1盐酸中,产生无色混合气体的体积在标准状况下为bL,反应后溶液呈中性,则a=____, b=____。
参考答案:(I)分子晶体;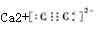
(2)O=C=O; Ca2+
(3)②④
(4)Si +2OH- + H2O==SiO32- +2H2↑
(5)0.25;2.8
本题解析:
本题难度:一般
2、填空题 右表是元素周期表的一部分。
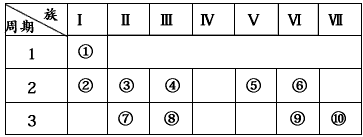
(1)表中元素⑩的氢化物的化学式为_________ ,此氢化物的还原性比元素⑨的氢化物的还原性__________ (填强或弱)。
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是____________ ,其单质的电子式为______________ 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是______________ 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式 ____________又如表中与元素⑦的性质相似的不同族元素是___________ (填元素符号)
参考答案:(1)HCl ;弱
(2)N;
(3)H、O、S
(4)Be(OH)2+2NaOH → Na2BeO2+2H2O ;Li
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的氧化性越强
B.断裂化学键一定吸收能量
C.位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则这两种离子的半径一定是X>Y
D.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的颗粒大小相同的锌,产生H2的起始速率相同,醋酸放出的氢气多
参考答案:B
本题解析:
本题难度:困难
4、填空题 填写表格
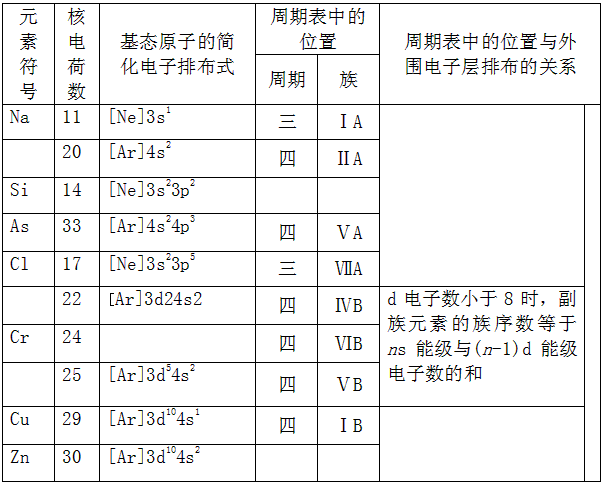
参考答案:
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.每一周期元素都是从碱金属开始,以稀有气体结束
B.f区都是副族元素,s区和p区的都是主族元素
C.已知在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol
D.Ge的电负性为1.8,则其是典型的非金属
参考答案:A.第一周期中,H不属于碱金属元素,2~6周期元素都是从碱金属开始,以稀有气体结束,故A错误;
B.f区为镧系和锕系元素,均在ⅢB族,为副族元素,s区为第ⅠA、ⅡA族元素,p区为ⅢA~ⅤⅡA元素与零族元素,则s区和p区的都是主族元素,故B正确;
C.第一电离能指的是气态电中性基态原子失去1个电子所需要的最低能量,20℃Na不是气态,则在20℃1molNa失去1mol电子需吸收650kJ能量,则其第一电离能不为650KJ/mol,故C错误;
D.一般电负性大于1.8的元素,为非金属,则Ge的电负性为1.8,则其既有非金属性又有金属性,故D错误;
故选B.
本题解析:
本题难度:简单