1、填空题 (8分)(1)粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质。在提纯时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是___________。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
(2)己知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,
参考答案:
本题解析:
本题难度:一般
2、填空题 (15分)某矿石中除含SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO,从该矿石中提取钴的主要工艺流程如下:
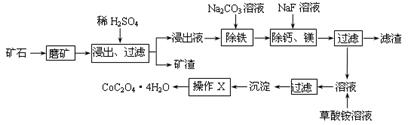 ?
?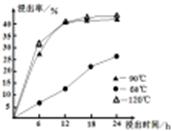
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。考虑生产成本和效率,最佳的浸出时间为?小时,最佳的浸出温度为?℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+?H2O+?Na2CO3=?Na2Fe6(SO4)4(OH)12↓+?Na2SO4+?CO2↑?
(3)“除钙、镁”的原理反应如下:MgSO4+2NaF=MgF2↓+Na2SO4; CaSO4+2NaF=CaF2↓+Na2SO4。已知KSP(CaF2)=1.11×10-10、KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中的c(Ca2+)/c(Mg2+)=?。
(4)“沉淀”中含杂质离子主要有?;“操作X”名称为?。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,电池反应为LiCoO2+ C6 CoO2+ LiC6。LiC6中Li的化合价为?价。若放电时有1mole-转移,正极质量增加?g。
CoO2+ LiC6。LiC6中Li的化合价为?价。若放电时有1mole-转移,正极质量增加?g。
参考答案:(1)12 ; 90 ;?(2)3,6,6,1,5,6;(3)1.50;
(4)SO42-、NH4+、Na+、F-; 洗涤、干燥 ;(5)0 ;7g
本题解析:(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如右图所示。由图可知:温度越高,浸出率越高,时间越长,浸出率。但是考虑生产成本和效率,最佳的浸出时间为12小时;最佳的浸出温度为90 ℃;(2)用化合价升降法配平化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3= Na2Fe6(SO4)4(OH)12↓+ 5Na2SO4+ 6CO2↑;(3)KSP(CaF2)= c(Ca2+)×c2(OH-)=1.11×10-10; KSP(MgF2)= c(Mg2+) ×c2(OH-)=7.40×10-11,所以c(Ca2+)/c(Mg2+)= KSP(CaF2)÷KSP(MgF2)= 1.11×10-10÷7.40×10-11=1.50;(4)由于沉淀是从含有SO42-、NH4+、Na+、F-离子的溶液中过滤出来的,所以“沉淀”中含杂质离子主要有SO42-、NH4+、Na+、F-。把沉淀表面的杂质离子洗去、然后干燥就得到固体CoC2O4·2H2O。因此“操作X”名称为洗涤、干燥。(5)因为在充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以LiC6中Li的化合价为价;若放电时有1mole-转移,则有1mol的Li变为Li+结合为LiCoO2,所以正极质量增加7g。
本题难度:一般
3、选择题 下列实验操作正确的是( )
A.验证AgI溶解度比AgCl小,向AgCl悬浊液中滴加KI溶液
B.中和滴定实验时,用待测液润洗锥形瓶
C.测定食醋溶液pH时,用蒸馏水润湿pH试纸
D.测定中和热时,用普通玻璃棒快速搅拌反应液
参考答案:A、依据沉淀转化的条件是利用反应向更难溶的方向进行分析;验证AgI溶解度比AgCl小,向AgCl悬浊液中滴加KI溶液,沉淀颜色从白色变化为黄色,证明碘化银溶解度小于氯化银,故A正确;
B、中和滴定实验时,用待测液润洗锥形瓶会增大待测溶液的体积,多消耗标准液,引起实验误差;依据误差分析判断测得结果增大,故B错误;
C、PH试纸湿润后再测定食醋溶液PH会稀释待测溶液,测定的溶液PH会增大,故C错误;
D、环形玻璃棒在搅拌时是上下移动搅拌,不易于玻璃杯碰撞,但一般的玻璃棒容易与玻璃杯碰撞,造成热量的增长或损失;故D错误;
故选A.
本题解析:
本题难度:简单
4、选择题 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项
| 陈述Ⅰ
| 陈述Ⅱ
|
A
| SO2可使酸性高锰酸钾褪色
| SO2有漂白性
|
B
| 浓硫酸具有脱水性和强氧化性
| 浓硫酸滴到湿润的蔗糖中,蔗糖变
成黑色海绵状
|
C
| SiO2有导电性
| SiO2可用于制备光导纤维
|
D
| BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀
| Ksp(BaSO4)<Ksp(BaCO3)
|
参考答案:B
本题解析:A、二氧化硫与酸性高锰酸钾溶液发生氧化还原反应而使高锰酸钾溶液褪色,体现二氧化硫的还原性,错误;B、浓硫酸具有脱水性,可使蔗糖变黑,同时浓硫酸还具有强氧化性,与碳元素发生反应生成二氧化碳、二氧化硫气体,使蔗糖呈疏松的海绵状,正确;C、二氧化硅是原子晶体,不具有导电性,但二氧化硅可用于制备光导纤维,用于传递光信号,与二氧化硅的导电性无关,错误;D、硫酸钡的饱和溶液中加入饱和的碳酸钠溶液,因为碳酸根离子浓度较大,使钡离子与碳酸根离子结合为碳酸钡沉淀,不是因为Ksp(BaSO4)<Ksp(BaCO3),错误,答案选B。
考点:考查物质性质的判断
本题难度:一般
5、选择题 在重铬酸钾(K2Cr2O7)溶液中存在如下平衡: Cr2O72-+H2O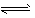 2HCrO4-
2HCrO4-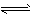 2H++2CrO42- ,向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
2H++2CrO42- ,向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
[? ]
A. Ag2Cr2O7
B. Ag2CrO4
C. AgHCrO4
D. Ag2O
参考答案:B
本题解析:
本题难度:一般