|
高中化学知识点归纳《难溶电解质的溶解平衡》高频试题特训(2020年最新版)(十)
2021-06-11 06:36:15
【 大 中 小】
|
1、选择题 已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
[? ]
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数
B.AgCl的Ksp=1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,[Ag+]=[Cl-],且Ag+和Cl-浓度的乘积等于1.8×10-10mol2·L-2
C.温度一定时,在AgCl饱和溶液中,Ag+和Cl-浓度的乘积是一个常数
D.向饱和AgCl溶液中加入盐酸,Ksp变大
|
参考答案:C
本题解析:A.在AgCl的饱和溶液中,Ksp=c(Cl-)·c(Ag+),若为不饱和溶液,Ksp>c(Cl-)·c(Ag+),错误; B.AgCl难溶,但溶于水的AgCl完全电离,AgCl是强电解质,错误;在AgCl的饱和溶液中,Ksp=c(Cl-)·c(Ag+),C正确;D.Ksp只与温度有关,温度不变,Ksp不变,错误。
考点:考查溶度积常数。
本题难度:一般
3、填空题 (8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法?
该法的工艺流程为?

其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显?色。
(2)能说明第①步反应达平衡状态的是??。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)?
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至?。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。?
(4)用Fe做电极的原因为??。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) ??。
溶液中同时生成的沉淀还有?。
参考答案:
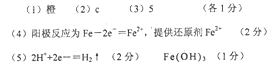
本题解析:(1)平衡体系的pH=2,即溶液为酸性溶液,则溶液显橙色;
(2)能说明第①步反应达平衡状态的是:溶液的颜色不变即各组分的浓度保持不变的状态;
(3)由Ksp=c(Cr3+)?c3(OH-)=10-32,可得,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(4)用Fe做电极的原因为:Fe为阳极,发生氧化反应,生成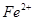 ,提供还原剂 ,提供还原剂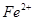 ,其电极反应式为: ,其电极反应式为: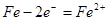 ; ;
(5)在阴极附近溶液pH升高的原因是: 。溶液中同时生成的沉淀还有氢氧化铁沉淀生成; 。溶液中同时生成的沉淀还有氢氧化铁沉淀生成;
本题难度:一般
4、填空题 根据以下信息回答下列问题。
Ⅰ .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。 .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
①请用离子方程式表示盐碱地产生碱性的原因:?;
②请用化学方程式表示 加入石膏降低土壤碱性的反应原理?; 加入石膏降低土壤碱性的反应原理?;
③请写出水垢悬浊液中CaSO4溶解平衡的离子方程式?;
④ 请分析水垢中的CaSO4转化为CaCO3的原理?; 请分析水垢中的CaSO4转化为CaCO3的原理?;
⑤请写出CaCO3溶于过量盐酸的离子方程式?。
参考答案:①CO32-+H2O 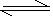 ?HCO3-+OH-, HCO3-+H2O ?HCO3-+OH-, HCO3-+H2O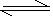 H2CO3+OH- H2CO3+OH-
②CaSO4+Na2CO3=CaCO3+ Na2SO4
③ CaSO4(s) 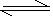 Ca2+(aq)+SO42-(aq) Ca2+(aq)+SO42-(aq)
④CaSO4的沉淀溶解平衡,加入Na2CO3溶液后,CO32- 与Ca2+结合生成更难溶于水的CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,CaSO4沉淀减少,CaCO3沉淀生成。
⑤CaCO3 +2H+= CO2↑+ H2O +Ca2+
本题解析:略
本题难度:简单
5、计算题 在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?(必须写出判断理由)(已知:Ksp(ZnS)=1.6×10-24mol2/L2?Ksp(CuS)=1.3×10-36mol2/L2)
参考答案:[S2-]=[KSP(ZnS)]1/2=[1.6×10-24mol2/L2]1/2=1.61/2×10-12mol/L
Q=[Cu2+]×[S2-]=0.001mol/L×1.61/2×10-12mol/L=1.61/2×10-15mol2/L2>Ksp(CuS)
所以有CuS沉淀产生。
本题解析:ZnS(s) Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-), Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-),
c(S2-)=[KSP(ZnS)]1/2=[1.6×10-24mol2/L2]1/2=1.61/2×10-12mol/L
CuS(s) Cu2+(aq)+S2-(aq),Q=c(Cu2+)c(S2-)=0.001×1.61/2×10-12=1.26×10-15>Ksp,故有沉淀生成。 Cu2+(aq)+S2-(aq),Q=c(Cu2+)c(S2-)=0.001×1.61/2×10-12=1.26×10-15>Ksp,故有沉淀生成。
本题难度:一般
|