1、选择题 由Na、Na2O、Na2O2组成的固体混合物,其中各组分的物质的量之和为0.1 mol,将其溶于水,所得溶液恰好能被150 mL浓度为1 mol/L的HCl溶液中和,下列相关描述说法不正确的是
A.中和生成的NaCl为0.15 mol
B.0.1 mol固体混合物与水反应生成H2和O2的体积比可能是1∶1
C.Na、Na2O、Na2O2物质的量之比可能是2∶1∶1
D.Na、Na2O、Na2O2物质的量之比可能是5∶3∶2
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列关于Na2CO3和NaHCO3的性质的比较中,不正确的是
A.热稳定性Na2CO3>NaHCO3
B.常温下在水中的溶解度Na2CO3>NaHCO3
C.与稀盐酸反应的剧烈程度Na2CO3>NaHCO3
D.等物质的量浓度的Na2CO3和NaHCO3溶液的PH:Na2CO3>NaHCO3
参考答案:C
本题解析:
本题难度:简单
3、选择题 化学与人类生活密切相关.下列化学物质的存在、获取和应用的相关描述正确的是
A.溴、碘元素虽然在海水中含量较低,但人类获取溴、碘还是来自海洋资源
B.饮用水可以用明矾、漂粉精来净化,两者的作用原理相同
C.煤干馏是为了获得锻炼烯烃
D.脂肪与石蜡都可以通过石油分馏获取
参考答案:A
本题解析:分析:A.溴、碘元素主要存在与海水中;
B.明矾与漂白精的净水原理不同;
C.煤干馏可得到可以得到生成焦炭、煤焦油、粗苯、煤气等;
D.脂肪属于烃的衍生物,不能通过石油分馏制得.
解答:A.溴、碘元素主要存在与海水中,虽然海水中含量较小,但总量丰富,故A正确;
B.明矾净水是由于明矾水解生成具有吸附性的氢氧化铝胶体,漂白精的净水原理时由于具有氧化性的原因,二者原理不同,故B错误;
C.煤干馏可得到可以得到生成焦炭、煤焦油、粗苯、煤气等,而烯烃通过石油裂解生成,故C错误;
D.脂肪属于烃的衍生物,不能通过石油分馏制得,故D错误.
故选A.
点评:本题考查较为综合,涉及海水的利用,明矾与漂白精的净水原理以及煤和石油的综合利用,侧重于化学应用的考查,题目难度不大,注意把握相关基础知识.
本题难度:简单
4、选择题 分别与1mol?Cl2发生反应,消耗质量最小的物质是
A.Fe
B.Cu
C.Mg
D.Na
参考答案:C
本题解析:分析:依据氧化还原反应的电子守恒分析计算;
解答:依据氧化还原反应的电子守恒;Cl2~2Cl-~2e-;Fe~Fe3+~3e-;Cu~Cu2+~2e-;Mg~Mg2+~2e-;Na~Na+~e-;得到3Cl2~2Fe~3Cu~3Mg~6Na;即Cl2~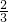 Fe~Cu~Mg~2Na
Fe~Cu~Mg~2Na
1mol氯气反应消耗的金属质量分别为:m(Fe)=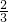 mol×56g?mol-1=37.3g;
mol×56g?mol-1=37.3g;
m(Cu)=1mol×64g?mol-1=64g;
m(Mg)=1mol×24g?mol-1=24g;
m(Na)=3mol×23g?mol-1=69g;
故选C.
点评:本题考查了氯气的化学性质,与金属反应的定量计算,特别注意与铁的反应.
本题难度:困难
5、选择题 下列物质与其用途相符合的是
①ClO2-消毒剂?
②NaHCO3-治疗胃酸过多?
③明矾-做干燥剂
④硅胶-做净水剂?
⑤Na2O2-呼吸面具的供氧剂?
⑥NaClO-漂白纺织物.
A.②④⑤⑥
B.①②⑤⑥
C.①②④⑤
D.全部
参考答案:B
本题解析:分析:①根据ClO2具有强氧化性分析;
②NaHCO3可与盐酸反应;
③明矾不具有吸水性;
④硅胶具有吸水性;
⑤Na2O2与二氧化碳反应生成氧气;
⑥NaClO可生成具有漂白性的HClO.
解答:①ClO2具有强氧化性,可做消毒剂,故①正确;
②胃酸的主要成分为盐酸,NaHCO3可与盐酸反应而治疗胃酸过多.故②正确;
③明矾不具有吸水性,不作干燥剂,但可作净水剂,故③错误;
④硅胶具有吸水性,可用作干燥剂,不能用作净水剂,故④错误;
⑤Na2O2与二氧化碳反应生成氧气,则可用作呼吸面具的供氧剂,故⑤正确;
⑥NaClO可生成具有漂白性的HClO,可用于漂白,故⑥正确.
故选B.
点评:本题考查常见物质的性质和用途,题目难度不大,本题注意物质的性质决定用途,学习中注意相关基础知识的积累.
本题难度:困难