1、填空题 下表列出了3种燃煤烟气脱硫方法的原理。

(1)方法I中氨水吸收燃煤烟气中SO2的化学反应为:
2NH3+SO2+H2O= (NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3
能提高燃煤烟气中SO2去除率的措施有____(填字母)。
A.增大氨水浓度 B.升高反应温度 C.使燃煤烟气与氨水充分接触 D.通人空气使HSO3-转化为SO42-
采用方法I脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是____ (用离子方程式表示)。
(2)方法Ⅱ中主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H =8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g) △H =90.4 kJ/mol
2CO(g) +O2(g)=2CO2(g) △H= -566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H= -483.6 kJ/moI
S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为___________________________
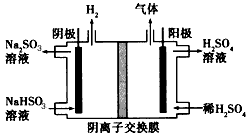
(3)方法Ⅲ中用惰性电极电解NaHSO3溶液的装置如下图所示。阳极区放出气体的成分为____(填化学式)。
参考答案:
(1)AC;HCO3-+SO2===CO2+HSO3-
(2)S( g) +O2(g)= SO2(g) △H = -574.0KJ/mol
(3)O2、SO2
本题解析:
本题难度:一般
2、选择题 LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极?FePO4+Li++e-=LiFePO4?负极?Li-e-=?Li+?下列说法中正确的是?
[? ]
A.充电时电池反应为FePO4+Li?=?LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动?
D.放电时,在正极上是Li+得电子发生氧化反应
参考答案:B
本题解析:
本题难度:一般
3、填空题 (14分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
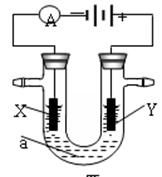
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。(说明:杂质发生的电极反应不必写出)
电解一段时间后,CuSO4溶液的浓度将 (填“变大”、“变小”或“不变”)
参考答案:(1)①2 H+ +2e- =H2 ↑ ②2 Cl--2e- =Cl2 ↑
(2)①粗铜, Cu -2 e- = Cu2+ ②纯铜, Cu2+ +2 e- =Cu 变小
本题解析:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:2H++2e-=H2↑;放出气体,溶液变红;②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑。故答案为:2Cl--2e-=Cl2↑;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,故答案为:纯铜; Cu2++2e-=Cu;②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,故答案为:粗铜,Cu-2e-=Cu2+ CuSO4溶液的浓度将变小
考点:原电池和电解池的工作原理
本题难度:一般
4、选择题 将质量相等的银片和铂片分别作为阳极和阴极用来电解硝酸银溶液
i.以电流强度为1A通电10分钟;
ii.10min后,反接电源,以电流强度为2A继续通电10分钟;下列图象分别表示:银电极质量,铂电极质量,及电解池产生气体质量和电解时间的关系图.正确的是( )
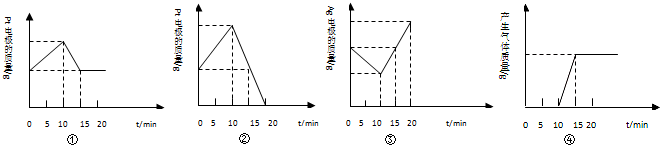
A.①③
B.①②③
C.②③④
D.①②③④
参考答案:将质量相等的银片和铂片插入足量硫酸银溶液中,银片与电源正极相连,铂片与电源负极相连,则Ag为阳极,发生Ag-e-=Ag+,Pt为阴极,发生Ag++e-=Ag,则Ag电极的质量减小,Pt电极的质量增加,然后反接电源,Pt电极为阳极,但表面有Ag,所以发生Ag-e-=Ag+,Ag为阴极,发生Ag++e-=Ag,则Pt电极的质量又减小,Ag电极的质量又增大,该过程中不生成气体,且电流强度比原来的大,则质量变化的程度比原来的大,当15min时Pt电极上Ag完全溶解后,Pt不失去电子,其质量不再变化,显然①、③图象符合,②④不符合,故①③正确,
故选A.
本题解析:
本题难度:一般
5、简答题 “化学与技术”模块
海洋是一座巨大的宝藏,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源.而以海水为主要原料的海洋化学工业,又被称为“蓝色化工”.
(1)常用的海水淡化方法有______法、______法(电渗析、反渗透)、冷冻法、离子交换法等.
(2)如图是电渗析法淡化海水的原理图.其中,电极A接直流电源的正极,电极B接直流电源的负极.
①隔膜A是______(填:阴离子交换膜或阳离子交换膜)
②从宁波港采集的海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-.
若用上述装置对采自宁波港的海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、
pHc,则其大小顺序为______.
③请写出用电渗析法对采自宁波港的海水进行淡化处理时所发生的化学反应方程式______.
(3)具有暂时硬度的硬水在长时间加热煮沸后,生成沉淀的主要成分是______.
(4)为获得纯净水(去离子水),某同学在实验室将含Mg2+、Ca2+、Cl-的硬水先后通过阴离子交换树脂[如RN(CH3)3OH]和阳离子交换树脂[如RSO3H],写出Cl-与上述离子交换反应的方程式______;结果实验未获得成功,其可能原因是______.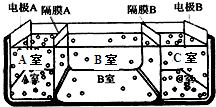
参考答案:(1)海水淡化常见的方法有:蒸馏法、膜法、冷冻法、离子交换法等,故答案为:蒸馏;膜;
(2)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜A和阳极相连,阳极是阴离子放电,所以隔膜A是阴离子交换膜,故答案为:阴离子交换膜;
②电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,故答案为:pHa<pHb<pHc;
③电解氯化钠的反应原理为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑;
(3)水垢的主要成分是氢氧化镁和碳酸钙,也是具有暂时硬度的硬水在长时间加热煮沸后生成沉淀的主要成分,故答案为:CaCO3、Mg(OH)2;
(4)阴离子交换树脂可以实现阴离子之间的交换,所以Cl-与阴离子交换树脂反应的方程式为:RN(CH3)3OH+Cl-═RN(CH3)3Cl+OH-,碱性环境下,镁离子易形成沉淀物,会堵塞了离子交换柱,所以离子交换树脂有时不起作用,故答案为:阴离子交换树脂交换出的OH-和Mg2+、Ca2+等反应生成沉淀堵塞了离子交换柱.
本题解析:
本题难度:一般