1、填空题 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: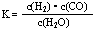 它所对应的化学反应为:_____________________________
它所对应的化学反应为:_____________________________
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为_____________________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是_________反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:________。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应 N2O4(g) 2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
2NO2(g) △H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___________。
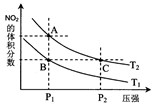
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)NO2可用氨水吸收生成NH4NO3。25℃时,将m mol NH4NO3溶于水,溶液显酸性,向该溶液滴加n L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb=2X10-5 mol·L-1)
(6)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如右图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
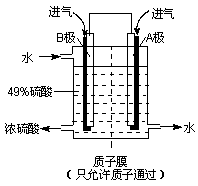
①溶液中H+的移动方向由______ 极到______极;(用A、B表示)
②B电极的电极反应式为__________________________。
参考答案: (1) C(s)+H2O(g)  CO(g)+ H2 (g) (1分)
CO(g)+ H2 (g) (1分)
(2)-246.4KJ/mol (2分) CH3OCH3-12e-+3H2O=2CO2+12H+ (2分)
(3)放热(1分) 75% (2分)
(4)D (2分) (5) 逆向 (2分) m/200n (2分)
(6)①B (1分) A (1分) ②SO2+2H2O-2e-=SO42-+4H+ (2分)
本题解析:(1)煤生成水煤气的反应为C(s)+H2O(g)  CO(g)+ H2 (g)。
CO(g)+ H2 (g)。
(2)观察目标方程式,应是①2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ? mol -1;负极以CH3OCH3和H2O作为原料,失去电子生成CO2和 H+
(3)升高温度,平衡常数减小,平衡左移,故正反应是放热反应;
CO(g)+H2O(g)?CO2(g)+H2(g) 反应是一定体积容器中设为1L,反应量为x
起始量(mol) 0.02 0.02 0 0
变化量(mol) x x x x
所得量(mol)0.02-x 0.02-x x x
根据K= c(CO2) ×c(H2)/( c(CO) × c(H2O) ),得 x2/(0.02-x)2=9,得x=0.015mol
转化率为0.015/0.02×100%=75%
(4)A、从A点到C点,温度相同,但是P2>P1,压强大,化学反应速率快,因此C>A
B、C点的压强大,容器体积小,浓度高,因此C点颜色深。
C、B,C两点的纵坐标数据相同,也就是各气体的体积分数相同,物质的量相同,其平均相对分子质量也相同
D、 该反应为吸热反应(可视为N2O4(g)=NO2(g)+NO2(g),为分解反应,吸热过程)。B到A的过程生产物NO2(g)的体积分数增多,反应正向移动,可以采用加热的方法。
(5)滴加氨水的过程中,将抑制水的电离。理由是加碱将抑制水的电离,故水的电离平衡将 逆向
.由电荷守恒得:n(NH4+) +n(H+)=n(NO3-) +n(OH-),
由于溶液呈中性,所以n(H+)= n(OH-),n(NH4+) =n(NO3-) =m
NH3H2O=(可逆)=NH4+ +OH-
X m /n 10-7
NH3H2O的店里平衡常数 Kb="c(" NH4+)×c( OH-)/C(NH3H2O)="[" ( m/n )×10-7 ]/x=2×10-5mol·L-1
所以x= m/200n mol·L-1
(6) 阳离子向正极移动,所以H+从B极向A极移动。
根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
考点:考查化学平衡知识
本题难度:困难
2、填空题 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)?+?H2O(g)? CO2(g)?+?H2(g)的平衡常数随温度的变化如下表:
CO2(g)?+?H2(g)的平衡常数随温度的变化如下表:

试回答下列问题
(1)上述反应的正反应是__________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_______(填“增大”、“减小”或“不变”),容器内混合气体的压强_____________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有_____________(选填A、B、C、D)。

(4)830℃时,在2?L的密闭容器中加入4?mol?CO(g)和6?mol?H2O(g)达到平衡时,CO的转化率是_______________。
参考答案:(1)放热?
(2)增大;增大?
(3)BC?
(4)60%
本题解析:
本题难度:一般
3、选择题 一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)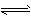 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
[? ]
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y 的浓度相等
参考答案:A
本题解析:
本题难度:一般
4、填空题 在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
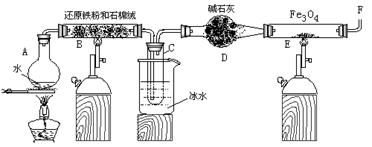
(1)烧瓶A中常加入碎瓷片,其作用是 ,B中石棉绒的作用 ,小试管C的作用是 。
(2)反应开始时先点燃 处(填A或B)酒精灯,为了安全,在E管中的反应发生前,在F出口处必须 ,E管中的反应开始后,在F出口处应 。
(3)写出高温下Fe 与H2O(g)反应的化学方程式 ,在一定条件下该反应实际上是可逆反应,试用化学平衡移动原理加以解释本实验中是如何实现Fe向Fe3O4的转变的 。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象____________________________________________________。
参考答案:26. (1) 防止液体暴沸;增大铁粉与水蒸气的接触面积;冷凝水蒸气。
(2)A;检验氢气的纯度;点燃氢气。(3) (2分);
(2分);
实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行。
(4)取滤液少量,向其中滴加KSCN溶液,若溶液变为血红色,即证明含有Fe3+。
本题解析:(1)烧瓶的作用就是加热液体或者对液体进行蒸馏,为了防止液体暴沸,常加入碎瓷片;B中发生反应 ,为了增大铁粉与水蒸气的接触面积,常放入石棉绒;因为利用产物H2进一步与四氧化三铁反应制取铁粉,所以需要将未反应的水蒸气除去,所以小试管C的作用是冷凝水蒸气;(2)因为氢气不能排放到空气中,氢气在空气中燃烧容易发生爆炸,所以反应开始时先点燃A处的酒精灯,为了安全,在E管中的反应发生前,在F出口处必须检验氢气的纯度,E管中的反应开始后,在F出口处应点燃氢气。(3)高温下Fe 与H2O(g)反应的化学方程式为
,为了增大铁粉与水蒸气的接触面积,常放入石棉绒;因为利用产物H2进一步与四氧化三铁反应制取铁粉,所以需要将未反应的水蒸气除去,所以小试管C的作用是冷凝水蒸气;(2)因为氢气不能排放到空气中,氢气在空气中燃烧容易发生爆炸,所以反应开始时先点燃A处的酒精灯,为了安全,在E管中的反应发生前,在F出口处必须检验氢气的纯度,E管中的反应开始后,在F出口处应点燃氢气。(3)高温下Fe 与H2O(g)反应的化学方程式为 ,为了使上述反应向右移动,根据平衡移动原理,可以不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行;(4)根据Fe3+的检验方法,最佳试剂用KSCN溶液,所以证明滤液中含有Fe3+的实验操作及现象是取滤液少量,向其中滴加KSCN溶液,若溶液变为血红色,即证明含有Fe3+。
,为了使上述反应向右移动,根据平衡移动原理,可以不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行;(4)根据Fe3+的检验方法,最佳试剂用KSCN溶液,所以证明滤液中含有Fe3+的实验操作及现象是取滤液少量,向其中滴加KSCN溶液,若溶液变为血红色,即证明含有Fe3+。
考点:考查铁粉与水蒸气的反应,实验基本操作,影响平衡移动的因素,离子的检验。
本题难度:一般
5、填空题 (10分)二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2 ②2MnO+O2
MnO+CO2 ②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰热分解反应的平衡常数表达式K= (分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为 。
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
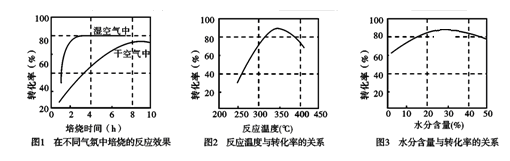
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制备反应合适的焙烧温度为 ,合适的含水量气氛条件为 。
(4)MnO2也可在MnSO4—H2SO4—H2O为体系的电解液中电解获得,其阳极的电极反应式为 ,电解后溶液的pH将 (填“增大”、“ 减小”或“不变”)。
参考答案:(1)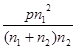 (2分)
(2分) 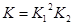 (2分)
(2分)
(2)< (1分) (3)350℃ (1分) 含水量30% (1分)
(4)Mn2+-2e-+2H2O = MnO2+4H+ (2分) 减小(1分)
本题解析:(1)根据题意和题给反应方程式知,碳酸锰热分解反应的平衡常数表达式K=P2(CO2)/P(O2)= 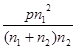 ;K1= P(CO2)、K2=1/P(O2),K与K1、K2关系为
;K1= P(CO2)、K2=1/P(O2),K与K1、K2关系为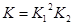 。(2)当△H—T△S<0时反应自发进行,反应②为气体物质的量减少的熵减反应,△S<0,且在低温下能自发进行,则其△H<0。(3)根据图1知,反应在湿空气中进行反应速率快,碳酸锰的转化率高;根据图2知,反应在350℃时碳酸锰的转化率最高,根据图3知,水分含量为30%时碳酸锰的转化率最高,该制备反应合适的焙烧温度为350℃,合适的含水量气氛条件为含水量30% 。(4)电解法制备MnO2阳极发生氧化反应,MnSO4被氧化为MnO2,根据电荷守恒和溶液的酸碱性知,其阳极的电极反应式为Mn2+-2e-+2H2O = MnO2+4H+,阴极发生还原反应,电极反应式为2H++2e-
。(2)当△H—T△S<0时反应自发进行,反应②为气体物质的量减少的熵减反应,△S<0,且在低温下能自发进行,则其△H<0。(3)根据图1知,反应在湿空气中进行反应速率快,碳酸锰的转化率高;根据图2知,反应在350℃时碳酸锰的转化率最高,根据图3知,水分含量为30%时碳酸锰的转化率最高,该制备反应合适的焙烧温度为350℃,合适的含水量气氛条件为含水量30% 。(4)电解法制备MnO2阳极发生氧化反应,MnSO4被氧化为MnO2,根据电荷守恒和溶液的酸碱性知,其阳极的电极反应式为Mn2+-2e-+2H2O = MnO2+4H+,阴极发生还原反应,电极反应式为2H++2e- H2,电解总反应为Mn2+-+2H2O
H2,电解总反应为Mn2+-+2H2O  MnO2+ H2+2H+,电解后溶液的pH将减小。
MnO2+ H2+2H+,电解后溶液的pH将减小。
考点:考查化学平衡常数表达式书写,化学反应方向,平衡图像分析和电解原理。
本题难度:困难