1、实验题 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
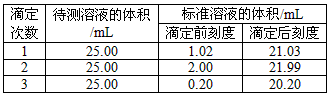
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
参考答案:(1)①偏高;②无影响;③B;④无;粉红(或浅红)
(2)18.85%
本题解析:
本题难度:一般
2、选择题 下列关于各实验装置图的叙述中,正确的是

[? ]
A.装置①可用于制取少量的蒸馏水
B.装置②可用于吸收NH3,并防止倒吸
C.以NaHCO3为原料,装置③可用于实验室制取少量CO2
D.装置④b口进气可收集Cl2
参考答案:A
本题解析:
本题难度:一般
3、实验题 美国计划2015年再次登陆月球,继而在月球上建立基地,给人类登陆火星作准备。为了早日实现梦想,1992年美国进行了第一次利用实际的月球岩石--玄武岩(FeTiO3,钛酸亚铁)来制造氧气的试验。已知FeTiO3被H2还原后,生成Fe、TiO2和水,被C还原后生成Fe、TiO2和
CO2;TiO2经过一系列处理后,可以制得纳米TiO2。请参与探究,并回答下列问题:
[探究一]为测定钛铁矿中可提取氧的质量分数,某研究性学习小组设计了以下两套实验装置
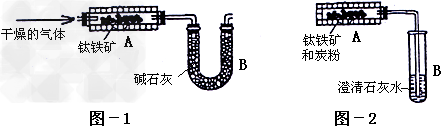
(1)学生甲设想用图-1装置(A为电加热装置)从钛铁矿中提取氧。请写出FeTiO3在加热时被H2还原的化学方程式_________________________和最简便的实验步骤________(选填下列数字编号)。
①通入N2;②停止通N2;③通入H2;④停止通H2;⑤加热;⑥停止加热;⑦称取装置B的质量。
(2)学生乙设想用图-2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO2可通过绿色植物的光合作用转化为营养物质,同时产生氧气:
6CO2+6H2O C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为________________。
C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为________________。
(3)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图-2装置在加热时,生成的CO2不可能全部被澄清石灰水吸收,同时钛铁矿和炭粉在加热时还会产生CO,给实验带来误差。
①请对学生乙的设想提出改进措施:改用图-1装置,并在U型管B之前增加盛有________?的燃烧管,________________。
②改进后,实验自始至终需持续向装置A中通入N2的目的是________________。
[探究二]纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(4)某科研小组在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如图所示,下列说法正确的是________。
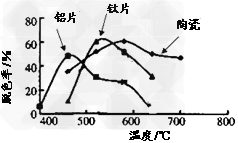
(a)不同载体,无论何种温度一定是钛片最好
(b)约在520℃时,钛片载体的光催化活性最好
(c)无论何种载体,催化活性总是随温度的升高而升高
(d)不同负载TiO2薄膜的光催化活性不同
参考答案:(1)FeTiO3+H2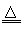 Fe+TiO2+H2O;③⑤⑥④⑦?
Fe+TiO2+H2O;③⑤⑥④⑦?
(2)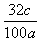 ?
?
(3)①CuO粉末;在B之后增加盛碱石灰的干燥管;②反应前将装置中的空气赶出,反应开始后可将CO2及时赶出使之被碱石灰吸收?
(4)bd
本题解析:
本题难度:一般
4、选择题 利用下列实验装置完成相应的实验,能达到实验目的的是? ?
[? ]
A.实验室中制取少量蒸馏水
B.分离碘和酒精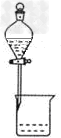 ? ?
? ?
C.称量氢氧化钠固体 ?
?
D.配制100?mL?0.10?mol·L-1盐酸 ?
?
参考答案:A
本题解析:
本题难度:简单
5、简答题 为测定某钢样组成,现取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况).
(1)计算此钢样粉末中铁和碳的物质的量之比.
(2)取三份不同质量的钢样粉末分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如表所示:
实验序号
I
II
III
加入钢样粉末的质量/g
2.812
5.624
8.436
生成气体的体积/L(标准状况)
1.120
2.240
2.800
|
请计算该硫酸溶液的物质的量浓度(写出计算过程).
参考答案:(1)n(CO2)=0.224L22.4L/mol=0.010?mol,由碳元素守恒计算钢中碳的质量m(C)=0.01mol×12g/mol=0.12?g,
所以n(Fe):n(C)=28.12g-0.12g56g/mol:0.01?mol=50:1;
答:此钢样粉末中铁和碳的物质的量之比为50:1;
(2)由表中数据可知,钢样的质量增大,氢气的体积增大,故实验Ⅰ、实验Ⅱ中硫酸有剩余,生成2.8L氢气需要钢样的质量为2.8L1.12L×2.812g=7.03g,故实验III中的H2SO4完全反应,所以有:n(H2SO4)=n(H2),即:c(H2SO4)×0.1?L=2.8L22.4L/mol,解得c(H2SO4)=1.25?mol/L;
答:该硫酸溶液的物质的量浓度1.25?mol/L.
本题解析:
本题难度:一般