1、选择题 下列各组物质,用一种试剂无法区别的是
A.FeC12、AgNO3、Na2CO3、Na2SO3
B.NaNO3、A1C13、NaCl、MgC12
C.苯、己烯、四氯化碳、乙醇
D.(NH4)2SO4、NH4Cl、Na2SO4、NaCl
参考答案:B
本题解析:A 用盐酸一种试剂能区别,没现象的是FeC12,有白色沉淀的是AgNO3,有无色无味气体生成的是Na2CO3,有无色有味的气体生成的是Na2SO3
B 不能用一种试剂区别
C 用溴水就能区别,加溴水之后,上层呈橙红色的是苯,褪色的是己烯,下层是橙红色的是四氯化碳,不分层的好似乙醇。
D 用氢氧化钡能区别,既有白色沉淀,又有刺激性气味的气体产生的是(NH4)2SO4,只有刺激性气味的气体产生的是NH4Cl,只有白色沉淀生成的是Na2SO4,无现象的是NaCl
故选B。
本题难度:一般
2、选择题 下列除去杂质所选用的试剂或方法完全正确的是(?)
A.除去NaCl溶液中的少量I2: 用无水乙醇,萃取分液
B.除 CO2中的少量HCl:通入饱和Na2CO3溶液,洗气
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D.除去NaHCO3固体中的少量Na2CO3:加热灼烧
参考答案:C
本题解析:A、乙醇与水互溶,不能用来萃取水溶液中的I2,错误;B、Na2CO3溶液也能吸收CO2,错误;C、Fe能把杂质FeCl3还原为FeCl2,正确;D、加热灼烧不能除去Na2CO3,还使NaHCO3分解,错误。
本题难度:一般
3、选择题 下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理
A
使用CCl4提取碘水中的碘
萃取分液
碘在CCl4中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
|
A.A
B.B
C.C
D.D
参考答案:A.碘不易溶于水,易溶于四氯化碳,则使用CCl4提取碘水中的碘,萃取后分液即可分离,故A正确;
B.乙酸乙酯与乙醇不分层,不能利用分液法分离,因利用蒸馏,故B错误;
C.NaCl的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响大,则除去KNO3固体中混杂的NaCl,应溶解后冷却热饱和溶液,结晶分离,故C错误;
D.丁醇与乙醚混溶,但二者沸点不同,则除去丁醇中的乙醚,利用蒸馏即可除杂,故D正确;
故选AD.
本题解析:
本题难度:简单
4、填空题 硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:
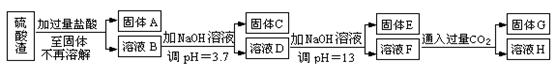
查资料得知:
物质名称
| 溶度积(Ksp)
| pH值
|
开始沉淀
| 完全沉淀
|
Mg(OH)2
| 5.6×10-12
| 9.3
| 10.8
|
Fe(OH)3
| 2.8×10-16
| 2.7
| 3.7
|
Al(OH)3
| 1.3×10-33
| 3.7
| 4.7
|
?
请回答下列问题:
(1)写出固体A的化学式为?。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是?。
A.石蕊试液? B.广泛pH试纸? C.精密pH试纸? D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E?;?②溶液F生成固体G?。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为?。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)=?。
参考答案:(1)SiO2(2分)
(2)CD(2分)
(3)Mg2++2OH―=Mg(OH)2↓(2分);? AlO2―+CO2+2H2O=Al(OH)3↓+HCO3―(2分)
(4)加热或高温或灼烧(2分)
(5)5.6×10―10mol/L(2分,无单位扣1分)
本题解析:(1)第一步中加过量盐酸,Fe2O3、Al2O3、MgO与盐酸反应溶解,SiO2不溶过滤可得;(2)A、只能判断溶液的酸碱性,错误;B、广泛pH试纸 只能精确到整数,错误;精密pH试纸 和pH计读数能精确的小数点后一位或更多;(4)流程中得到的固体为氢氧化物,加热灼烧可得氧化物;
(5)溶液H为调节pH=13后得到的溶液,c(OH-)=0.1 mol/L
c(Mg2+)= Ksp÷c2(OH-)= 5.6×10-12÷0.12=5.6×10―10mol/L
本题难度:一般
5、填空题 (14分) Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法:
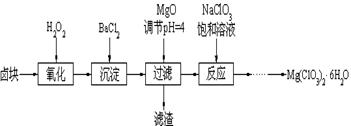
已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
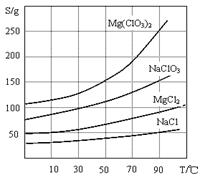
2、几种化合物的溶解度(S)随温度(T)变化曲线如上图。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③?;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式?。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果?(填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为?(计算结果保留两位小数) 。
参考答案:(14分)(1)?SO42-?(2分) ?
静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-已沉淀完全(2分)
(2)趁热过滤 (2分)
(3)6H++ClO3-+6Fe2+==6Fe3++Cl-+3H2O (3分)
(4)不变 (2分)
(5) 78.31%?(3分)
本题解析:(1)加入BaCl2的目的是除去SO42-,钡离子与硫酸根离子结合呈硫酸钡沉淀,过滤除去;检验SO42-是否除尽的方法是静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-已沉淀完全;
(2)Mg(ClO3)2的溶解度受温度变化影响大,温度高时溶解度较大,温度低时溶解度较小,所以需要趁热过滤除去氯化钠;
(3)步骤2中所发生反应是ClO3-与Fe2+在酸性条件下的氧化还原反应,生成氯离子和铁离子、水,离子方程式为6H++ClO3-+6Fe2+==6Fe3++Cl-+3H2O;
(4)滴定管在加入标准液前必须用标准液润洗,所以最终结果不变;
(5)根据消耗K2Cr2O7溶液15.00mL可计算未被ClO3-氧化的亚铁离子的物质的量是0.015L×0.1mol/L×6=0.009mol,则被ClO3-氧化的亚铁离子的物质的量是0.02L×1mol/L-0.009mol=0.011mol,则100mL溶液中ClO3-的物质的量是0.011mol×1/6×10=0.11/6mol,则样品中Mg(ClO3) 2·6H2O的质量为0.11/6mol/2×299g/mol=2.741g,所以产品中Mg(ClO3) 2·6H2O的质量分数为2.741g/3.5g×100%=78.31%.
本题难度:困难