1、简答题 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.
请回答下列问题:
(1)X元素在周期表中的位置是______.
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入______(填物质名称);负极电极反应式为______.
(3)C在一定条件下反应生成A的化学方程式是______.
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法中,正确的是______(填写下列各项的序号).
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大.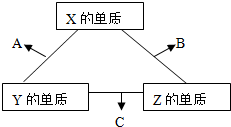
参考答案:X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体;?短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),判断为氢氧燃料电池,X、Y、Z三种短周期元素,它们的原子序数之和为16,XZ为O2、H2结合转化关系判断,Y原子序数为7,X为N元素,X+Z=B;Z+Y=A,一个B分子中含有的Z原子个数比C分子中少1个,说明Z元素为H,则X、Y、Z分别为O、N、H,A、B、C分别为NO、H2O、NH3;
(1)X为氧元素,元素周期表中位于第2周期,ⅥA族,故答案为:2周期,ⅥA族;
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,是氢氧燃料电池,负极为氢气发生氧化反应,正极为正极发生还原反应,所以正极反应为:氧气;负极电极反应式为:H2+2OH-=2H2O+2e-;
(3)C为NH3在一定条件下反应生成A为NO,是氨气的催化氧化,反应的化学方程式:4NH3+5O2?高温?.催化剂4NO+6H2O,故答案为:4NH3+5O2?高温?.催化剂4NO+6H2O;
(4)Y的单质(N2)与Z的单质(H2)生成C(NH3)的反应是可逆反应,△H<0,反应为:N2+3H2催化剂.高温高压2NH3;,△H<0;
a、化学平衡的标志是正逆反应速率相同,故a正确;
b、将等物质的量的Y(N2)、Z(H2)的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应,设起始量都为1mol,则
? N2+3H2催化剂.高温高压2NH3
起始量? 1? 1? 0
变化量? x? 3x? 2x
平衡量 1-x? 1-3x? 2x
所以氮气所占体积分数为物质的量的百分数=1-x2-2x×100%=50%,所以Y(N2)的单质的体积分数始终为50%,故b正确;
c、达到化学平衡时,Y(N2)的单质的体积分数始终为50%,H2和NH3共占50%,所以两种单质在混合气体中的物质的量之比不为1:1,故c错误;
d、达到化学平衡的过程中,气体质量不变,气体物质的量减小,所以混合气体平均相对分子质量增大,故d错误;
e、到化学平衡后,再升高温度,反应是放热反应,平衡逆向进行,C(NH3)的体积分数减小.故e错误;
故选ab.
本题解析:
本题难度:一般
2、填空题 (10分)A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
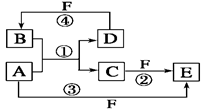
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则C的电子式为?,反应④的化学方程式为_______________________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。请写出在水溶液中进行的反应②的离子方程式?;
已知光照条件下D与F反应生成B,写出该反应的化学方程式:?。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为?。
参考答案:(1) 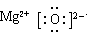 ?
?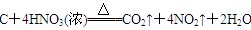
(2)? 2Fe2++Cl2?=== 2Fe3++2Cl-?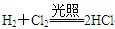
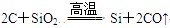
(3)?
本题解析:(1)红棕色气体是NO2,所以F是浓硝酸。①是置换反应,在常见金属置换非金属的反应中,除了活泼金属置换氢气外,就是镁在CO2中燃烧生成单质碳,方程式为2MgO+CO2 2MgO+C,即A是镁,B是CO2,C是MgO,D是碳。
2MgO+C,即A是镁,B是CO2,C是MgO,D是碳。
(2)常见的变价金属的单质是铁,根据框图可知A、C、E中均含有铁元素,且价态不同,所以F应是具有氧化性的氯气。即A、B、C、D、E、F分别为Fe、HCl、FeCl2、H2、FeCl3、Cl2。
(3)根据框图可知A、C、E中均含有A元素,且价态不同,所以可能是碳元素。又因为在高温下碳可以置换SiO2中的硅,方程式为SiO2+2C Si+2CO↑。即A、B、C、D、E、F分别为C、SiO2、CO、Si、CO2、O2。
Si+2CO↑。即A、B、C、D、E、F分别为C、SiO2、CO、Si、CO2、O2。
本题难度:一般
3、推断题 物质A~G有下图所示转化关系(部分反应物、生成物没有列出).其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀.

请回答下列问题:
(1)写出下列物质的化学式:B________、E__________、G________;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是________,阴极物质是________,电解质溶液是________;
(3)反应②的化学方程式是_______________________.
参考答案:(1)SO2;H2SO4;Cu2O
(2)粗铜;精铜;CuSO4溶液
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
本题解析:
本题难度:一般
4、选择题 已知A、B为单质,C为化合物,能实现下述转化关系的是( )
A+B
CA+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2SO3,放出SO2气体,则A可能是H2
③若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
④若C溶液中滴加KSCN溶液显红色,则B可能为Fe.
A.①②
B.③④
C.①④
D.②③
参考答案:由A+B点燃
本题解析:
本题难度:一般
5、推断题 (选做题)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:


请填写下列空白:?
(1)写出下列物质的化学式:B___________J__________。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M________________。②I溶于G______________。?
(3)在通常状况下,若1?g?C气体在B气体中燃烧生成H气体时放出92.3?kJ热量,则2?mol?H气体完全分解生成C气体和B气体的热化学方程式为____________________。
参考答案:(1)B:Cl2;J:NO?
(2)①H+?+ClO-=?HClO;NH3+H2O NH3H2O
NH3H2O NH4++OH-? ?
NH4++OH-? ?
(3)2HCl(g)=H2(g)+Cl2(g) △H=?+184.6?kJ/mol
本题解析:
本题难度:一般