1、选择题 某学生设计了如图的方法对A盐进行鉴定,由此分析,下列结论中,正确的是( )

A.A中一定有Fe3+
B.A可能为FeBr2溶液
C.C中一定有Fe3+
D.B为AgI沉淀
参考答案:BC
本题解析:
本题难度:简单
2、填空题 (9分)、下列A~K是中学化学中的常见物质,其中D、E、K为单质,其余物质为化合物。这些物质具有下列转化关系(省略了水和部分反应物及生成物),除反应②外,其他反应均在水溶液中进行。其中D是工业中最常用的金属。?回答:
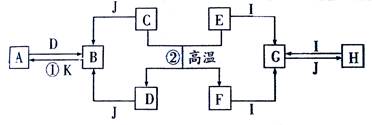
(1)A、H分别为??、??(填化学式)
(2)写出反应②的化学方程式?。
(3) 2.7克E与I完全反应生成G,若G与J反应生成3.9克不溶物H ,则消耗J的物质的量为?。
(4)若实验测得无水H在常压条件下不同温度时的密度为:
T(℃)
| 200
| 600
| 800
|
ρ(g/L)
| 6.881
| 2.650
| 1.517
|
气体摩尔体积(L/mol)
| 38.8
| 71.6
| 88.0
|
则 600℃时无水H存在形式的分子式为?。
参考答案:(9分)、(1)FeCl3(1分)、?Al(OH)3?或A1C13(2分,一个1分)
(2)3FeO+2Al 3Fe+Al2O3(2分,无条件扣1分)
3Fe+Al2O3(2分,无条件扣1分)
(3)0.05mol或0.25mol (2分,一个1分)
(4)A12C16和 A1C13(2分,不全不给分)
本题解析:略
本题难度:一般
3、填空题 (10分)图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。

回答下列问题:
(1)元素X在元素周期表中的位置为第________周期________族。
(2)一定条件下,Z能与H2反应生成ZH4,写出Z与NaOH反应的化学方程式
?
(3)写出由Y与NO、H2O生成D反应的化学方程式:?。
(4)X在高温下能与水蒸气反应,请写出该反应的化学方程式:?
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
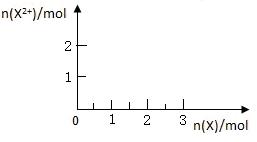
参考答案:
本题解析:略
本题难度:一般
4、简答题 铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如图所示工艺流程:
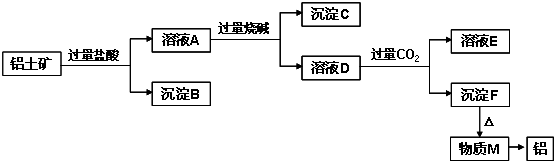
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是______(填操作名称).
(2)沉淀B的成分是______(填化学式,下同),B可以用来制普通玻璃,化学方程式是______,______;沉淀C的成分是______;溶液D中存在较多的阴离子是______.
(3)沉淀F转化为物质M的化学方程式为______;由物质M制取铝的化学方程式为______;溶液D中通入过量CO2生成沉淀F的离子方程式为______.
参考答案:Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al,
(1)分离溶液与沉淀,常用过滤的方法,故答案为:过滤;
(2)由以上分析可知沉淀B的成分是SiO2,工业常用纯碱、石灰石和石英为原料制造玻璃,反应的相关方程式为Na2CO3+SiO2高温.Na2SiO3+CO2↑、CaCO3+SiO2高温.CaSiO3+CO2↑,沉淀C为Fe(OH)3和Mg(OH)2,溶液D主要成分为NaAlO2,还含有过量的NaOH和NaCl,则溶液中存在的阴离子为AlO2-,OH-,Cl-,
故答案为:SiO2;Na2CO3+SiO2高温.Na2SiO3+CO2↑;CaCO3+SiO2高温.CaSiO3+CO2↑;
Fe(OH)3和Mg(OH)2;AlO2-,OH-,Cl-;
(3)沉淀F为Al(OH)3,加热分解得到M为Al2O3,方程式为2Al(OH)3△.Al2O3+3H2O,Al2O3经电解可得到
Al,方程式为2Al2O3(熔融)电解.冰晶石4Al+3O2↑,溶液NaAlO2中通入过量CO2生成Al(OH)3沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al(OH)3△.Al2O3+3H2O;2Al2O3(熔融)电解.冰晶石4Al+3O2↑;
CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-.
本题解析:
本题难度:一般
5、推断题 物质X、Y、Z有如下转化关系:
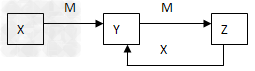
请回答下列问题:
(1)若X、Y、Z中均含有铝元素,则Y的化学式是____________,实验室用明矾制取该物质的离子方程式为___________________。
(2)若M是某元素的最高价氧化物且为气态,此元素的最高价与最低价化合价代数和为0?,X是由电子数均为10的阴阳离子组成,则Y溶液中离子浓度大小的顺序为___________________________。
(3)?若X为黄绿色气体,M是常见金属。完成下列问题:
①?X能与石灰乳反应制取漂白粉,其离子方程式_________________
②含M的一种盐可以作为杀菌消毒、净水剂,其一种制备方法是:以M(OH)3、NaClO和KOH为原料,请写出此反应的离子方程式___________________
③M(OH)3溶液中存在如下的沉淀溶解平衡:M(OH)3(s) M3+?(aq)?+?3OH-(aq)? 常温下,M(OH)3的溶度积Ksp?=?4.0?×?10-38,要使M3+离子浓度降至10-5mol/L,溶液的PH应调至_________。?(lg2=0.3,lg5=0.7)
M3+?(aq)?+?3OH-(aq)? 常温下,M(OH)3的溶度积Ksp?=?4.0?×?10-38,要使M3+离子浓度降至10-5mol/L,溶液的PH应调至_________。?(lg2=0.3,lg5=0.7)
参考答案:(1)Al(OH)3;Al3+?+?3NH3·H2O?=?Al(OH)3↓+?3NH4+
(2)c(Na+)?>?c(CO32-)?>?c(OH-)?>?c(HCO3-)?>?c(H+)
(3)①?Cl2?+?Ca(OH)2?=?Ca2+?+?ClO-?+?Cl-?+?H2O;②?2Fe(OH)3?+?3ClO-?+?4OH-?=?2FeO42-+3Cl-?+?5H2O;③3.2
本题解析:
本题难度:一般