1、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+
参考答案:A
本题解析:电解饱和食盐水时,阳极上Cl-放电:2Cl--2e-=Cl2;氢氧燃料电池的负
极发生氧化反应,应是H2失电子;精炼铜时,粗铜与电源正极相连;钢铁发生电
化学腐蚀的负极反应式为Fe-2e-=Fe2+。
本题难度:一般
2、选择题 下列各项正确的是?
?
| 电极反应式
| 出现环境
|
A
| H2-2e—=2H+
| 碱性环境下氢氧燃料电池的负极反应
|
B
| 4OH——4e—=O2↑+2H2O
| 中性环境下钢铁的吸氧腐蚀
|
C
| 2H++2e—=H2↑
| 用Cu作电极电解NaOH溶液的阴极反应
|
D
| H2—2e—=2H+
| 用惰性电极电解H2SO4的阳极反应
|
?
参考答案:C
本题解析:A. 错误,氢氧燃料电池在碱性条件下H+会与OH—反应。H2+ 2OH—-2e—=2H2O。
B.错误,中性环境下钢铁的吸氧腐蚀:2H2O+ O2+ 4e—= 4OH—
C.准确。
D. 惰性电极电解H2SO4的阳极反应:2H2O-4e-==O2↑+4H+
点评:书写电极反应式要能准确的判断电极反应,得失电子情况。
本题难度:一般
3、选择题 右图为模拟铁生锈的实验。铁粉中均匀混有少量碳粉,撒入在内壁已分别用氯化钠溶液和稀醋酸润湿过的甲、乙两支具支试管。打开止水?夹片刻后,以下有关该实验的说法合理的是? (? )
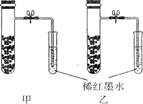
A.甲装置中红墨水倒吸量比乙装置多
B.甲装置中发生的电化学腐蚀主要是吸氧腐蚀
C.乙装置中发生的电化学腐蚀主要是析氢腐蚀
D.乙装置开始导管口有气泡冒出,接着红墨水又较快倒流
参考答案:BD
本题解析:,甲装置中发生的电化学腐蚀主要是吸氧腐蚀,乙装置开始导管口有气泡冒出,接着红墨水又较快倒流,主要是压强差造成的。
本题难度:一般
4、选择题 下列现象或事实可用同一原理解释的是( )
A.MnO2与氯酸钾制氧气和MnO2与浓盐酸制氯气
B.镀锌铁和镀锡铁在镀层被破坏后铁的腐蚀情况不同
C.乙烯和NaOH溶液都能使溴水退色
D.蛋白质溶液中加入硫酸钠浓溶液或硫酸铜溶液时均生成沉淀
参考答案:A、氯酸钾制氧气时二氧化锰作催化剂,MnO2与浓盐酸制氯气时二氧化锰作氧化剂,所以二氧化锰的作用不同,故A错误;
B、镀锌铁镀层被破坏后形成的原电池铁作正极,降低铁的腐蚀;镀锡铁在镀层被破坏后形成的原电池铁作负极,加快铁的腐蚀,故B正确;
C、乙烯和溴水发生加成反应而使溴水褪色,溴水和氢氧化钠溶液反应生成溴化钠、次溴酸钠和水而使溴水褪色,所以反应原理不同,故C错误;
D、硫酸钠浓溶液能使蛋白质析出,为盐析,该反应是可逆的;硫酸铜溶液能使蛋白质变性,该反应不可逆,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如下:
Ni(OH)2 + M NiOOH + MH,下列叙述正确的是(?)
NiOOH + MH,下列叙述正确的是(?)
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M + H2O + e-= MH + OH-
C.充电时阳极反应为:NiOOH + H2O + e-= Ni(OH)2 + OH-
D.放电时每转移1mol电子,正极有1mol NiOOH被氧化
参考答案:A
本题解析:
正确答案:A
充电时阴极反应为:M + H2O + e-= MH + OH-,阳极为:Ni(OH)2 + OH-―e―= NiOOH + H2O ,负极:MH + OH-―e―= M + H2O ,正极:NiOOH + H2O + e-= Ni(OH)2 + OH-,A正确,B不正确,充电时阴极;C、不正确,为放电时正极反应。D、不正确,应是正极有1mol NiOOH被还原。
本题难度:简单