1、选择题 下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
参考答案:A.发生电化学腐蚀时,金属应不纯,则纯银器主要发生化学腐蚀,故A正确;
B.铁比锡活泼,当镀锡铁制品的镀层破损时,铁易被腐蚀,故B错误;
C.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故C正确;
D.防止金属被氧化,金属应连接电源的负极,如连接正极,加剧腐蚀,故D错误.
故选AC.
本题解析:
本题难度:简单
2、填空题 I.现将反应2Fe3+ + 2I- ?2Fe2+ + I2设计成如下图所示的原电池
?2Fe2+ + I2设计成如下图所示的原电池
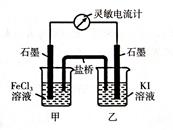
(1)能说明反应达到平衡的标志是__________;(填序号)
a.电流计读数为零
b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂-饱和KCl溶液,反应过程中的Cl-移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时___________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为____________________________。
II.如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。
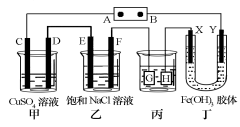
(4)装置乙中电极F的电极反应式____________________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为____________________;
(6)欲用装置丙进行粗铜精炼,电极G应该是____________________;
(7)装置丁中电极_______附近红褐色变深,说明氢氧化铁胶粒带正电荷。
参考答案:(1)a(2)乙(3)甲,2Fe2+-2e-= 2Fe3+
(4)2H+ + 2e-= H2↑(5)1:2(6)粗铜(7)Y
本题解析:(1)根据常温下能自动发生的氧化还原反应都可设计成原电池,再利用正反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极,利用负极发生氧化反应,正极发生还原反应,当电流计为零时,说明没有电子发生转移,则反应达到平衡,故a正确;(2)阴离子向正极移动,故反应过程中的Cl-移向乙烧杯;(3)当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,发生氧化反应,电极反应方程式为2Fe2+-2e-= 2Fe3+;(4)根据图片知,该装置是电解池,将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,电极反应式2H+ + 2e-= H2↑;(5)甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,生成1mol氧气需要4mol电子,生成1mol铜时需要2mol,电子所以转移相同物质的量的电子时生成单质的物质的量之比为1:2;(6)若用装置丙进行粗铜精炼,电镀时,镀层作阳极,镀件作阴极,故G为粗铜;(7)电解池中带正电荷的微粒向阴极移动,带负电荷的微粒向阳极移动,Y为阴电极,故电极Y附近红褐色变深。
本题难度:一般
3、实验题 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、K1O3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
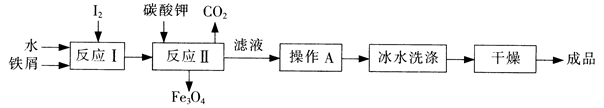
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为??。
②操作A包括??;用冰水洗涤的目的是??。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是??,
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水??kg。
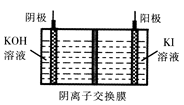
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 ??。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比?(选填“增大”、“减小”或“不变”)。
参考答案:
(1)①Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑
②加热浓缩、冷却结晶、过滤?洗涤除去表面可溶性杂质,同时减少KI的溶解损失
(2)①在较高温度下K1O3易分解?②1700?③I一+3H2O  IO3一+3H2↑?增大
IO3一+3H2↑?增大
(每空2分,本题共14分)
本题解析:工业流程题,(1)①根据化合物中铁元素与碘元素的质量比为21:127计算出原子个数比,得出化学式Fe3I8,根据反应物和产物书写化学方程式;②从溶液中分离晶体一般采用降温结晶法,滤液一般为稀溶液,故要浓缩,所以操作为加热浓缩、冷却结晶、过滤;洗涤的目的是除去表面杂质,冰水、相应饱和溶液、乙醇等均是减少晶体的溶解损失;(2)①在较高温度下K1O3易分解;②反应方程式为 5H2O2+I2=2HIO3+4H2O? HIO3+KOH=KIO3+H2O,
n(H2O2)=5/2n(KIO3)=15×103mol,m(H2O2)=15×103×34÷30%=1.7×106g=1700kg
③根据图示可知,阳极:5OH-+I—-5e- =IO3? + H2O,阴极:2H++2e- =H2↑,故总方程式为I-+3H2O  IO3-+3H2↑;电解过程中氢离子放电,溶液中OH-浓度增大,pH增大。
IO3-+3H2↑;电解过程中氢离子放电,溶液中OH-浓度增大,pH增大。
本题难度:困难
4、选择题 下列与金属腐蚀有关的说法正确的是
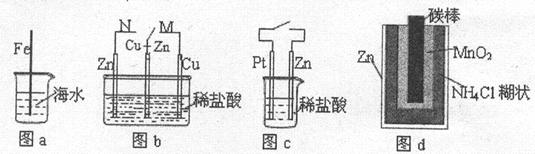
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,工作时NH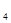
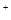 的移动方向为由里向外
的移动方向为由里向外
参考答案:B
本题解析:图a中,铁棒发生化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,A项错误;图b中开关由M置于N,Cu一Zn作正极,腐蚀速率减小,B对;图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,C项错误;图d中干电池放电时MnO2发生还原反应,体现还原性,D项错误,答案选B。
点评:金属腐蚀的速度:电解池的阳极>原电池的负极>正常化学反应。
本题难度:一般
5、选择题 下列物质的有关事实与电化学腐蚀无关的是
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀
D.在空气中,金属镁、铝的表面可形成一层氧化膜
参考答案:D
本题解析:A、用锌块来防止船体的锈蚀,正确;B、镀锡的铁制品破损后,腐蚀的是铁,而镀锌的铁制品破损后,腐蚀的是较活泼的锌,而铁被保护起来,正确;C、潮湿疏松土壤提供了形成原电池的条件:电解质溶液和充足的氧气,会导致发生吸氧腐蚀,正确;D、金属镁、铝的表面可形成一层氧化膜是因为发生了化学腐蚀。与电化学腐蚀无关。
本题难度:简单