1、选择题 为了保护地下钢管不受腐蚀,可以将钢管与
A.直流电源的正极相连
B.与铜板相连
C.与锌板相连。
D.与锡板相连
参考答案:C
本题解析:
本题难度:简单
2、填空题 某课外兴趣小组用下图装置进行实验,试回答:
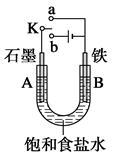
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做?,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为?。
参考答案:(1)O2+2H2O+4e-=4OH-?(2)牺牲阳极的阴极保护法,
2H++2e-=H2↑ 或2H2O+2e-= H2↑+2OH-。 (3)Fe-2e-= Fe 2+
本题解析:(1)开关K与a连接,此反应为原电池,A电极为正极,反应方程式为:O2+2H2O+4e-=4OH-
(2)开关K与b连接,此反应为电解池,用于金属的防护的这种防护措施叫做牺牲阳极的阴极保护法。B电极为阴极发生还原反应,反应方程式为:2H++2e-=H2↑或2H2O+2e-= H2↑+2OH-
(3)开关K与b连接,铁和石墨棒互换位置,铁为阳极,发生氧化反应,反应的离子方程式为:Fe-2e-= Fe 2+
本题难度:一般
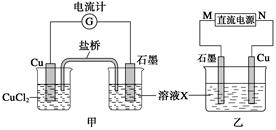
3、填空题 某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
 ?
?
①图中X溶液是_____________________________;
②石墨电极上发生的电极反应式为__________________________________________;
③原电池工作时,盐桥中的____________(填“K+”或“Cl-”)不断进入X溶液中。
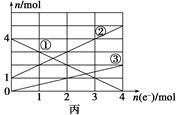
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是__________极;
②图丙中的②线是______________的变化。
③当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O=Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
参考答案:(1) ①FeCl3、FeCl2?②Fe3++e-=Fe2+ K+ (1分)
(2)①负(1分)?②Fe2+ ③2.8
(3)
本题解析:(1)①参照反应的自发性,Cu只能和FeCl3反应。②为正极,Fe3++e-=Fe2+③阳离子向正极移动。(2)参照图像中与电子的关系,可以发现③时铜的变化量,所以Cu作阳极。则石墨作阴极。②线与 电子关系是1:1,可以推出是Fe2+。当电子为2mol时,阳离子有Cu2+ 1mol,Fe3+ 2mol Fe2+ 3mol.共需要OH- 14mol,溶液体积为2.8L。(3)①Fe+8OH--6e-=FeO42-+4H2O②2Fe(OH)3+3ClO-+4OH-=2=FeO42-+3Cl-+5H2O
本题难度:一般
4、选择题 常温时,将500 ml pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生。下列说法错误的是(?)
A.若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuCO3
B.b<a<7
C.阳极电极反应:2H2O—4e—=O2↑+4H+
D.整个过程中是阳极产生氧气,阴极析出铜单质
参考答案:A
本题解析:
本题的关键是看到在整个电解过程中始终发现只有一个电极有气体产生,马上就知道整个过程中是阳极产生氧气,阴极析出铜单质,要恢复电解前的溶液就要将氧气和铜的质量转化成CuO或CuCO3,需要20(10-b-10-a)g CuO。考虑水解a<7,电解转变成酸则b<a。
本题难度:一般
5、选择题 下列叙述正确的是?(?)
A.在原电池的负极和电解池的阴极上都是发生氧化反应
B.铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀
C.用惰性电极电解饱和NaCl溶液,若有2mol电子转移,则生成1molNaOH
D.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
参考答案:B
本题解析:略
本题难度:简单