1、选择题 下列与金属腐蚀有关的说法正确的是
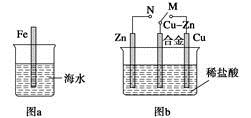
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu?Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn?MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
参考答案:B
本题解析:A项,插入海水中的铁棒靠近液面的位置与氧气接触,易发生吸氧腐蚀;B项,开关由M改置于N时,Zn作负极,Cu?Zn合金作正极,合金受到保护;C项,接通开关形成原电池,Zn作负极,Zn的腐蚀速率增大,但气体是在Pt电极上生成;D项,Zn?MnO2干电池自放电腐蚀主要是Zn发生氧化反应而自放电。
本题难度:一般
2、选择题 下列电化学实验装置正确的是( )
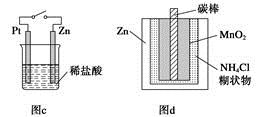
|
A.电解精炼铜
| B.验证电解饱和氯化钠溶液
(含酚酞)的产物
|

|
C.在铁制品上镀铜
| D .构成原电池
|
?
参考答案:B
本题解析:粗铜精炼时,应让粗铜作阳极,故A错误。电解饱和氯化钠溶液时,碳棒作阳极产生氯气,可用淀粉KI溶液检验,铁棒作阴极,产生氢气,收集后可利用爆鸣实验检验,B正确。在铁制品上镀铜时,应使铁制品作阴极,故C错误。若Fe与FeCl3的反应构成原电池反应,则两者不能直接接触,将装置中的FeCl2溶液与FeCl3溶液互换即可达到目的,故D错误。
点拨:本题考查电解精炼、电镀等电化学知识,意在考查考生运用电化学理论知识解决实际问题的能力。
本题难度:一般
3、选择题 如下图,铁腐蚀由快到慢的顺序为(电解质溶液为水)
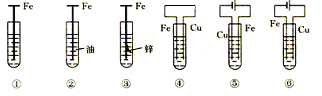
A.⑥>④>③>②>①>⑤
B.⑤>③>①>②>④>⑥
C.⑤>④>①>②>③>⑥
D.⑤>④>②>①>③>⑥
参考答案:C
本题解析:
正确答案:C
⑤铁作电解池的阳极腐蚀最快④铁作原电池的负极,加快腐蚀①在潮湿的空气中生锈②有油作保护③牺牲阳极的阴极保护⑥外加电流的阴极保护腐蚀最慢。
本题难度:一般
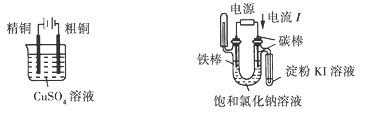
4、填空题 (11分)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
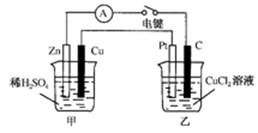
(1)甲装置的名称是_______;乙装置的名称是_______;Zn为_______极;Pt为______极。
(2)写出电极反应式:Cu极________________;C极________________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色______(填“变深”、“变浅”或“无变化”)。
(4) 若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
参考答案:(1)甲装置名称是原电池;乙装置名称是电解池;Zn为负极;Pt为阳极。
(2) Cu极2H++2e-=H2↑;C极Cu2++2e-=Cu。
(3)乙中溶液的颜色无变化
(4)甲中溶液的pH将增大;乙中溶液的pH将增大
本题解析:(1)甲池为锌铜原电池,活性较强的锌做负极,铜为正极;与外电源正极相连的Pt电极为阳极,碳棒为阴极
(2)Cu极:2H++2e-=H2↑;?C极:Cu2++2e-=Cu
(3)乙池中电极都换成铜电极时,阳极:Cu—2e-=Cu2+;阴极:Cu2++2e-=Cu,即溶液中Cu2+的浓度不改变,溶液的颜色无变化
(4)甲池中总反应Zn+2H+=Zn2++H2↑,H+浓度减小,酸性减弱,pH增大;而乙池中总反应为:2Cl-+2H2O=H2↑+Cl2↑+2OH-,OH-离子浓度增大,碱性增强,pH增大
本题难度:一般
5、选择题 下列装置中(杯中均盛有海水)能使铁受到保护不被腐蚀的是
[? ]
A.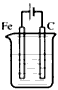
B.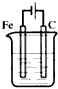
C.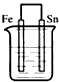
D.
参考答案:B
本题解析:
本题难度:一般