1、选择题 进行过滤操作应选用的一组仪器是
[? ]
A.玻璃棒、滤纸、烧瓶、漏斗、铁架台
B.滤纸、烧杯、试管夹、漏斗、玻璃棒
C.漏斗、玻璃棒、烧杯、铁架台、滤纸
D.烧杯、酒精灯、试管、铁架台、漏斗
参考答案:C
本题解析:
本题难度:简单
2、简答题 X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.现做以下实验:
①将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色.
②分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象.
(1)根据上述事实,推断这四种盐的化学式分别为:
X______?Y______?Z______
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离.其流程图如图:
部分物质溶解性表
| ? | ?Ba2+ | ?Cu2+ | ?Ag+
?Cl-
?溶
?溶
?不
?CO?32-
?不
?不
?不
?SO?42-
?不
?溶
?不
?S2-
?溶
?不
?不
|
①沉淀1的化学式为______.
②写出混合液+A的离子方程式______.
③若C为Na2S,且它与B属于同一类盐,则B试剂的名称是______.______.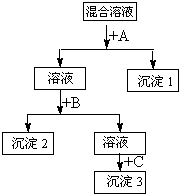
参考答案:(1)X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.依据离子共存可知,Ag+只能和NO3-形成盐溶液硝酸银溶液,硫酸根离子只能和铜离子形成硫酸铜溶液,另一种是氯化钡溶液;将三种盐各取少量,分别溶于盛有5mL蒸馏水的三支试管中,只有X盐溶液呈蓝色.说明X为铜盐为硫酸铜;分别向三支试管中加入2mL稀盐酸,发现Y盐溶液中产生白色沉淀,证明是硝酸银溶液,Z盐溶液无明显现象为氯化钡溶液;X:CuSO4?Y:AgNO3?Z:BaCl2
故答案为:CuSO4:AgNO3:BaCl2;
(2)依据物质溶解度和流程可知,先加入盐酸A沉淀银离子,过滤然后加入硫酸盐溶液B沉淀钡离子,最后加入硫化钠C沉淀铜离子;
①依据沉淀顺序和溶解度分析判断,沉淀1的化学式AgCl;
故答案为:AgCl;?
②混合液+A的反应是利用氯离子沉淀银离子,反应的离子方程式Ag++Cl-═AgCl↓;
故答案为:Ag++Cl-═AgCl;?
③若C为Na2S,且它与B属于同一类盐,所以可以是硫酸钠或硫酸氢钠;
故答案为:硫酸钠或硫酸氢钠;
本题解析:
本题难度:一般
3、选择题 为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是(?)
序号
| 物质
| 杂质
| 除去杂质应选用的试剂或操作方法
|
①
| KNO3溶液
| KOH
| 滴入稀HNO3同时用pH计测定至溶液呈中性
|
②
| FeSO4溶液
| CuSO4
| 加入过量铁粉并过滤
|
③
| H2
| CO2
| 依次通过盛有NaOH溶液和浓硫酸的洗气瓶
|
④
| NaNO3
| CaCO3
| 加稀盐酸溶解、过滤、蒸发、结晶
|
A、①②③? B、②③④? C、①③④? D、①②③④
参考答案:A
本题解析:碳酸钙能和盐酸反应生成氯化钙、水和CO2,所以又引入杂质氯化钙,选项④不正确,应该是过滤,其余都是正确的,答案选A。
本题难度:一般
4、实验题 某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O.
该小组探究过程如下:
●查阅资料:
①镁、铝、锌都是银白色的金属;
②锌(Zn)可以与NaOH溶液反应生成H2;
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O;
④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+.
|
● 提出假设:
(1)假设①:该混合金属粉末中除镁外还含有________元素
假设②:该混合金属粉末中除镁外还含有________元素
假设③:该混合金属粉末中除镁外还含有铝、锌元素
●实验探究:
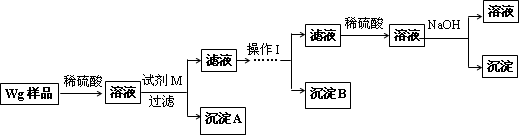
甲同学基于假设③设计实验方案如下:
乙同学同样基于假设3设计另一实验方案如下:
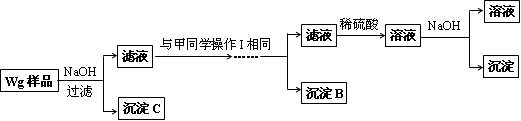
(2)试剂M是____________,沉淀B是_____________.
(2)试剂M是____________,沉淀B是_____________.
(3)丙同学认为乙同学的方案比甲同学的好,理由是_______________________.
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是____________________________.
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入_______________,直至生成的沉淀刚好溶解,再加入足量的____________________.
参考答案:(1)① 铝(或Al) (1分)?② 锌(或Zn)?(1分)
(2)NaOH溶液?(2分)? Al(OH)3 (2分)?
(3)步骤简单,节约试剂(2分)
(4)将沉淀C洗涤、干燥后称量(2分)
(5)稀硫酸(2分)?稀氨水 (2分)
本题解析:(1)某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,所以假设①和②分别为除镁外还含有铝和锌。
(2)试剂M的作用为把Mg2+转化为Mg(OH)2沉淀,所以为NaOH溶液;加过量氨水可得到沉淀B,所以沉淀B为Al(OH)3。
(3)乙同学的方案比甲同学的方案少一步,所以乙同学方案的优点是步骤简单,节约试剂。
(4),因为Al、Zn能与NaOH反应,所以加入NaOH得到的沉淀C为Mg,将沉淀C洗涤、干燥后称量即可得到Mg的质量。
(5)在滤液中逐滴加入稀硫酸,可得到Al2(SO4)3和ZnSO4,再加入稀氨水可得到沉淀B为Al(OH)3和含[Zn(NH3)4]2+的滤液。
本题难度:一般
5、选择题 某氯化镁溶液的密度为d?g/cm3,其中镁离子的质量分数为w,a?mL该溶液中Cl—的物质的量为:
A.mol
B.mol
C.mol
D.mol
参考答案:D
本题解析:
本题难度:简单