1、选择题 下列仪器中,常用于物质分离的是(? )。
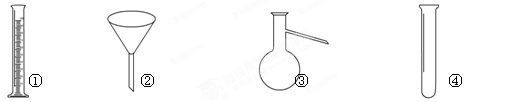
A.①③
B.②③
C.②④
D.①②
参考答案:B
本题解析:①量筒用来量取液体,②漏斗用来过滤进行分离难溶性固体与液体的混合物,③蒸馏烧瓶是用来分离互溶的沸点不同的两种或多种混合物的仪器,④试管是用来进行小剂量化学反应的仪器。因此常用于物质分离的是②③。选项为B。
本题难度:简单
2、选择题 如下表除去杂质应选用的试剂或操作方法,正确的是( )
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法
A
KNO3溶液
KOH
加入FeCl3溶液,并过滤
B
FeCl3溶液
FeCl2
加入稍过量双氧水后放置
C
CO
O2
通过灼热的Cu网后收集气体
D
K2CO3固体
NaHCO3
置于坩埚中加热
|
A.A
B.B
C.C
D.D
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列物质可用来鉴别乙酸溶液和乙醇的是?
A.稀盐酸
B.水
C.氯化钠溶液
D.碳酸钠溶液
参考答案:D
本题解析:乙醇和乙酸都是和水互溶的,但乙酸显酸性,能和碳酸钠溶液反应生成CO2气体,据此可以鉴别,答案选D。
点评:该题主要是考查学生对乙醇和乙酸性质的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范实验能力。
本题难度:简单
4、选择题 在标准状况下,1.6L氮气中含m个分子,则阿伏加德罗常数为
A.14m
B.28m
C.
D.7m
参考答案:A
本题解析:分析:根据n=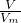 =
=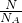 计算.
计算.
解答:n(N2)=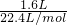 =
=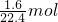 ,
,
则NA=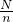 =
= =14m,
=14m,
故选A.
点评:本题考查阿伏加德罗常数的计算,题目难度不大,注意有关计算公式的运用.
本题难度:困难
5、填空题 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:
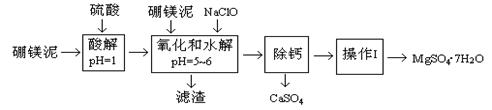
已知:NaClO与Mn2+反应产生MnO2沉淀。
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
|
开始沉淀pH
| 2.3
| 4.0
| 7.6
|
完全沉淀pH
| 4.1
| 5.2
| 9.6
|
?
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有?、?。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有?、?。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式:?。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
?。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是?。
A.KSCN溶液? B.淀粉KI溶液?C.H2O2 ?D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃)
| 40
| 50
| 60
| 70
|
MgSO4
| 30.9
| 33.4
| 35.6
| 36.9
|
CaSO4
| 0.210
| 0.207
| 0.201
| 0.193
|
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤?、?。
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为?(相对分子质量:MgSO4·7H2O-246? MgO-40)。
参考答案:(1)烧杯、100mL容量瓶(2分) (2)MnO2,SiO2(2分)
(3)Mn2++ClO-+H2O=MnO2↓+2H++Cl-(3分)? 2Fe2++ClO-+2H+=2Fe3++Cl-+H2O(3分)(4)A(2分)?(5)蒸发浓缩,趁热过滤(2分) ?(6)80.0%(2分,写80%也给分)
本题解析:(1)由于实验室没有80ml容量瓶,所以要配制1.00mol/L的硫酸80.0mL,则需要100ml容量瓶。所以若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯和100ml容量瓶。
(2)由于NaClO与Mn2+反应产生MnO2沉淀,又因为于二氧化锰和二氧化硅都不与稀硫酸反应,所以在滤渣中存在,因此滤纸中还有MnO2,SiO2。
(3)由于NaClO与Mn2+反应产生MnO2沉淀,在反应中氯元素的化合价从+1价降低到-1价,得到2个电子。Mn元素的化合价从+2价升高到+4价,失去2个电子,因此氧化剂与还原剂的物质的量之比是1:1,则NaClO与Mn2+反应产生MnO2沉淀的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;由于溶液中有亚铁离子,能够被次氯酸钠氧化成铁离子,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O。
(4)铁离子能和KSCN溶液反应使溶液显红色,所以可以向溶液中加入硫氰化钾溶液检验溶液中是否存在三价铁离子,方法为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+,A正确;由于溶液中含有次氯酸钠,能氧化碘化钾,所以不能使用碘化钾,B不正确;双氧水和酸性高锰酸钾溶液均具有强氧化性,不能检验铁离子,CD不正确,答案选A。
(5)由于温度对硫酸镁、硫酸钙的溶解度影响不同,温度越高,硫酸钙溶解度越小,所以要将MgSO4和CaSO4混合溶液中的CaSO4除去可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;而操作“I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到了MgSO4?7H2O。
(6)100g硼镁泥中氧化镁的物质的量=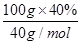 =1mol,根据镁原子守恒,生成MgSO4?7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,所以MgSO4?7H2O的产率=
=1mol,根据镁原子守恒,生成MgSO4?7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,所以MgSO4?7H2O的产率=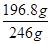 ×100%=80.0%。
×100%=80.0%。
本题难度:一般