1、选择题 下图是一些重要工业生产的转化关系(反应条件略去):

请完成下列问题:
⑴若D是单质,且与A属于同一主族,则?。
①反应的化学方程式是?。
②D的原子结构示意图是?。
③D单质的一种重要用途是?。
⑵若B为黄色固体,D为固体化合物,则
①该反应的化学方程式是?。
②生产该工业品的工厂应建在离?较近的地方。
③实验室检验C的方法是?。
⑶若C是一种有刺激性气味的气体,则
①C的分子形状是?。
②实验室进行此实验时,常看到有大量白烟产生,请说明产生大量白烟的原因。
③化合物C在一定体积的容器中,在一定条件下发生反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式?。
参考答案:⑴①2C+SiO2  Si+2CO↑
Si+2CO↑
② 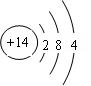 ?③制半导体材料?(2+1+1分)
?③制半导体材料?(2+1+1分)
⑵①4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
②消费中心?③将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色 (2+1+2分)
⑶①三角锥形(有错别字无分)
②生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟。
③3NO="NO2+N2O?" (1+2+3分)
本题解析:略
本题难度:一般
2、选择题 下列物质的工业制备原理的方程式书写正确的是
A.乙醇:C6H12O6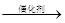 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
B.乙烯:CH3CH2OH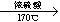 CH2=CH2↑+ H2O
CH2=CH2↑+ H2O
C.盐酸:NaCl+H2SO4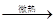 NaHSO4+HCl↑
NaHSO4+HCl↑
D.纯碱:2NaCl+2NH3+CO2+H2O → Na2CO3↓+ 2NH4Cl
参考答案:A
本题解析:A、采用葡萄糖生产乙醇,正确;B、该法为实验室制法,工业用石油裂解制备,错误;C、实验室制法,工业采用氢气与氯气反应制的,错误;D、该反应得到溶解度更小的碳酸氢钠晶体,错误。
本题难度:一般
3、选择题 在接触法产生H2SO4的过程中,对“废气、废水、废渣、废热”的处理正确的是( )
①废气用氨水处理 ②污水用石灰乳处理 ③废渣用来造水泥或炼铁 ④设置“废热”锅炉产生蒸气来供热或发电
A.只有①②
B.只有①③④
C.只有①②③
D.全部
参考答案:D
本题解析:SO2等废气可以用氨水吸收制得化肥硫酸铵等;污水显酸性可以用石灰乳处理;炉渣和矿灰可作为炼铁的原料;硫酸工业的反应都是放热反应,不但可以自行提供能量,还可以向外界提供能量,以降低成本。
本题难度:一般
4、选择题 下列化工生产过程中不涉及氧化还原反应的是
A.氯碱工业
B.硫酸工业
C.玻璃工业
D.合成氨工业
参考答案:C
本题解析:略
本题难度:一般
5、填空题 氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
 压强(Mpa) 压强(Mpa)
 氨的平 氨的平
衡含量(%)
温度(℃)
| 0.1
| 10
| 20
| 30
| 60
| 100
|
200
| 15.3
| 81.5
| 86.4
| 89.9
| 9 5.4 5.4
| 98.8
|
300
| 2.2
| 52.0
| 64.2
| 71.0
| 84.2
| 92.6
|
400
| 0.4
| 25.1
| 38.2
| 47.0
| 65.2
| 79.8
|
500
| 0.1
| 10.6
| 19.1
| 26.4
| 42.2
| 57.5
|
600
| 0.05
| 4.5
| 9.1
| 13.8
| 23.1
| 31.4
|
回答下列有关问题:
(1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。
(2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。
(3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
(4)将1molH2和1molN2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,测得NH3的物质的量为0.3mol,此时若移走0.5molH2和0.5molN2,则反应达到新的平衡时,NH3的物质的量为_____________(选填答案编号)。
A.0.3mol
B.0.15mol
C.小于0.15mol
D.大于0.15mol,小于0.3mol
参考答案:(1)(1分)放热。
(2)(2分)压强过大,需要的动力越大,对材料的强度和设备制造的要求也越高。
(3)(3分)
?
?
?
增大
减小
可能增大也可能减小
(4)(2分)C。
本题解析:略
本题难度:一般