1、选择题 下列对硫酸生产中化学反应原理的分析正确的是? ( )。
A.硫酸生产中涉及的三个化学反应因原料的不同可能全部是非氧化还原反应
B.硫酸生产中涉及的三个化学反应都是放热反应
C.硫酸生产中涉及的三个化学反应都需要使用催化剂
D.硫酸生产中涉及的三个化学反应都需要在较高温度条件下进行
参考答案:B
本题解析:三个化学反应都是放热反应;三个反应中只有SO2―→SO3需使用催化剂;SO3―→H2SO4在常温下进行,且是非氧化还原反应。
本题难度:一般
2、实验题 (11分)钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
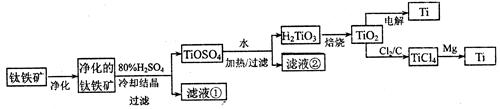
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和?
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是:?.
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是:?。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为:?.
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12(g) TICl4(l) +O2(g)顺利进行的原因是:?
TICl4(l) +O2(g)顺利进行的原因是:?
参考答案:

本题解析:略
本题难度:一般
3、填空题 斯坦福大学R M. Trost教授提出了绿色化学的核心概念-原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:
原子利用率=
下面是新型自来水消毒剂ClO2的四种制取方法,请填空:
(1)氯酸钠和盐酸法:本方法的化学方程式为2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62. 2%,其阳极的电极反应式为ClO2--e- ==ClO2↑,阴极的电极反应式为____。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53. 6%,此反应的化学方程式为___。
(4)联合工艺法:本方法的反应原理由三步组成。
①电解热的氯化钠溶液:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯: 2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O
此方法的原子利用率最大为______%(保留一位小数)。
参考答案:(1)37.6
(2)2H++2e-==H2↑(或2H2O+2e-==H2↑+2OH-)
(3)2NaClO2+Cl2=2NaCl+2ClO2
(4)94.4
本题解析:
本题难度:一般
4、选择题 “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
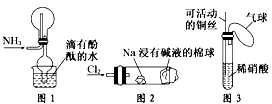
[? ]
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
参考答案:C
本题解析:
本题难度:一般
5、选择题 合成氨工业有下列生产流程,其先后顺序为(?)
①原料气制备?②氨的合成?③原料气净化和压缩?④氨的分离
A.①②③④
B.①③②④
C.④③②①
D.②③④①
参考答案:B
本题解析:按合成氨工业流程,原料气制备→原料气的净化和压缩→合成氨→氨的分离是其正确的顺序。
本题难度:简单