1、填空题 “温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。

根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”或“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
参考答案:(1)abc(2分)(2)C2H4(g)+H2O(l)=C2H5OH(l) △H="-44.2" kJ/mol(2分)
(3)①增大(2分)②放(2分)
本题解析:(1)a.采用节能技术能减少化石燃料的使用,减少化石燃料的使用就减少了二氧化碳的排放,正确;b.化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,正确;c.利用太阳能、风能能减少化石燃料的使用,化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,正确;故选abc。
(2)2CO2(g)+2H2O(l)
本题难度:困难
2、填空题 (14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
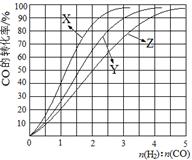
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
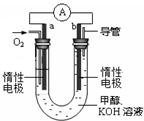
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
参考答案:(每空2分,共14分)(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=—443.5 kJ
本题解析:
本题难度:困难
3、选择题 在相同条件下,下列三个热化学方程式中△H比较正确的是( )
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H1
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H2
(3)
CH4(g)+O2(g)=CO2(g)+H2O(g);△H3.
A.△H1<△H2<△H3
B.△H1>△H2,△H3=△H1
C.△H1=△H2=△H3
D.无法比较
参考答案:因CH4(g)+2O2(g)=CO2(g)+2H2O(g)是燃烧反应,反应均放热,△Η<0,
? CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1
? CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
因水由气态变成液态,放出热量,所以△H1>△H2,
又反应热的数值与化学方程式前面的系数成正比,所以,△H3=12△H1,
故选B.
本题解析:
本题难度:一般
4、填空题 A、B、C、D、E是五种原子序数依次递增的短周期元素,已知:其中只有一种是金属元素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素原子质子数的2倍;B的最外层电子数是电子层数的两倍;C、A可形成两种常见的液态化合物甲和乙,且相对分子质量乙比甲大16。
(1)E元素的名称为: ;D的原子结构示意图为 。
(2)化合物乙中含有的化学键是 (填“极性共价键”或“非极性共价键”)。
(3)A单质与B、C形成的化合物可合成一种新型汽车动力燃料甲醇。
已知CO(g)+1/2O2(g)=CO2(g)
ΔH=-283 kJ/mol
H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ/mol
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)
ΔH=-651 kJ/mol
写出A与所选化合物合成甲醇的热化学方程式: 。
(4)EC2与C、D形成的化合物发生氧化还原反应的化学方程式为: 。
参考答案:(1)硫 
(2)极性共价键、非极性共价键
(3)CO(g)+2H2(g)=CH3OH(g) ΔH=-116 kJ·mol-1
(4)Na2O2+SO2=Na2SO4
本题解析:短周期元素中同种主族元素的C、E两种元素,E的原子序数是C的2倍,E为S,C为O;B的最外层电子数是电子层数的两倍,且B的原子序数小于C,B为碳元素;A与O元素形成两种常见的液态化合物,A为H,D为Na,乙为H2O2,甲为H2O。
(1)Na的原子结构示意图为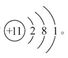
(2)H2O2中含有的化学键为极性共价键、非极性共价键。
(3)H2与CO反应制备CH3OH的热化学方程式,根据
CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ/mol ①
H2(g)+1/2O2(g)=H2O(g) ΔH=-242 kJ/mol ②
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-651 kJ/mol ③可知,①+②×2-③即得该热化学方程式CO(g)+2H2(g)=CH3OH(g) ΔH=-116 kJ·mol-1。
(4)SO2与Na2O2发生氧化还原反应生成Na2SO4,反应的化学方程式为Na2O2+SO2=Na2SO4。
本题难度:一般
5、填空题 醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:
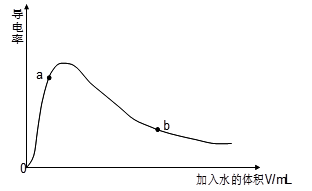
①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
参考答案:(1)①醋酸为共价化合物,只在水溶液中才能电离(2分);
②<;>;=(3分,各1分);
③1.3×10-3 (1分); 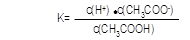 ="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
="(" 1.3×10-3)2/0.10 mol/L=1.7×10-5 mol/L
(2)CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol (3分)
(3)c(CH3COOH)+c(CH3COO-)=2c(Na+)或c(CH3COOH)+c(CH3COO-)=0.1mol/L;
c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4分;各2分)
本题解析:(1)①醋酸是共价化合物,液态醋酸中不存在自由移动的离子;
②对于弱电解质溶液而言,溶液越稀越易电离,所以b点醋酸的电离程度大于a点,H+的物质的量b点大于a点;尽管氢离子物质的量在增大,但增大的幅度不如溶液体积增大的多,所以离子浓度减小,因此b点醋酸根离子浓度小于a点;无论a还是b点,醋酸的物质的量不变,所以需要氢氧化钠的物质的量相等;
③醋酸电离产生等浓度的CH3COO-和H+,所以此时c(CH3COO-)约为1.3×10-3 mol/L;b点的平衡常数K= c(CH3COO-)·c(H+)/ c(CH3COOH)=( 1.3×10-3 mol/L)2/0.10mol/L=1.7×10-5 mol/L;
(2)将已知2个热化学方程式相加得:CH3COOH(aq)+ OH-(aq) = H2O(l) +CH3COO-(aq) △H=-56.0kJ/mol 即为稀醋酸与稀烧碱溶液反应的热化学方程式;
(3)醋酸电离使溶液呈酸性,醋酸钠水解使溶液呈碱性,浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,说明醋酸的电离程度大于醋酸钠的水解程度。则混合液中的物料守恒有:醋酸和醋酸根离子的浓度和是钠离子浓度的2倍,c(CH3COOH)+c(CH3COO-)=2c(Na+);或者混合液中醋酸和醋酸根离子的浓度和是0.10mol/L,c(CH3COOH)+c(CH3COO-)=0.1mol/L;根据以上分析,醋酸的电离程度大于醋酸钠的水解程度,所以混合液中离子浓度最大的是醋酸根离子,其次是钠离子,再次是氢离子,最小是氢氧根离子,c(CH3COO-)>c(Na+)c(H+)>c(OH-)。
考点:考查弱电解质溶液的离子浓度、电离平衡的判断,热化学方程式的书写,混合液的物料守恒及离子浓度大小的比较
本题难度:困难