1、选择题 下列关于一定原子轨道上运动的电子的几种判断正确的是(?)
A.一个原子轨道上只能有一个电子
B.处在同一原子轨道上的电子运动状态完全相同
C.处在同一能级中的电子(基态)能量一定相同
D.处在同一电子层上的电子(基态)能量一定不同
参考答案:C
本题解析:一个原子轨道上可以有2个电子,A不正确;处在同一原子轨道上的电子运动状态不相同,B不正确;处在同一电子层上的电子(基态)能量一定相同,C正确,D不正确,答案选C。
点评:该题是基础性试题的考查,试题注重基础,侧重对学生基础性知识的巩固和检验,难度不大。该题的关键是记住电子的运动特点以及核外电子排布规律。
本题难度:简单
2、选择题 某元素R有两种同位素,可分别表示为85R和87R,若R的近似相对原子质量为85.5则85R原子的质量分数为
A.75%
B.25%
C.74.6%
D.64.7%
参考答案:C
本题解析:元素的近似相对原子质量=(各元素原子的质量数×同位素在自然界中的质量分数)之和;
设85R原子的质量分数为x,则85×x+87×(1—x)=85.5;得x=74.6%
本题难度:一般
3、选择题 带核的原子结构模型是下列哪位科学家提出的
A.道尔顿
B.阿伏加德罗
C.玻尔
D.卢瑟福
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列物质中,有固定熔、沸点的是
A.天然气
B.石油
C.甲烷
D.汽油
参考答案:C
本题解析:分析:具有固定的熔点、沸点的物质一定是纯净物.
解答:A.天然气是混合物,主要成分是甲烷,故A错误;
B.石油是含多种烃的混合物,故B错误;
C.甲烷只含一种物质是纯净物,有固定熔、沸点,故C正确;
D.汽油主要成分为C4~C12脂肪烃和环烃类,并含少量芳香烃和硫化物,是混合物,故D错误.
故选C.
点评:本题考查纯净物的性质,难度不大,根据物质具有固定的熔点、沸点判断物质为一定是纯净物是解题关键.
本题难度:一般
5、填空题 A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。A与B等物质的量反应生成D和一种气体单质;C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,式量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g·L-1。
(1)A的化学式是???。Y的电子式是???。
(2)X的沸点比同主族同类型物质要高,原因是???。
(3)写出E与足量盐酸反应的化学方程式?
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式???。
(5)A的一个重要应用是根据2A →P +H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为?。
(沉淀Ksp=2.3×10-9,当溶液中离子浓度≤10-5mol·L-1,即可认为完全沉淀)
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在?。
参考答案:(1)HCOONa(2分)?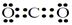 ?(2分)
?(2分)
(2)水分子间存在氢键(2分)?
(3)Na3N+4HCl=3NaCl+NH4Cl(2分)
(4)2Na++CO32-+H2O+CO2==2NaHCO3↓(2分)
(5)2.3×10-4mol·L-1(2分)
(6)将所得气体先通过足量NaOH溶液,再通过澄清石灰水,无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在。(3分)(其它合理答案也给分)
本题解析:① 已知A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性。则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸盐,B的碱性最强,则B为NaOH。② X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2。③ 由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3;即2 NaHCO3 Na2CO3 +CO2↑+H2O; NaHCO3 +NaOH =Na2CO3 +H2O;?由此可确定X为H2O,Y为CO2。④ 由有机羧酸盐A与NaOH等物质的量反应生成Na2CO3和一种气体单质,可联想到由无水醋酸钠与NaOH加热反应制取甲烷的脱羧反应:
Na2CO3 +CO2↑+H2O; NaHCO3 +NaOH =Na2CO3 +H2O;?由此可确定X为H2O,Y为CO2。④ 由有机羧酸盐A与NaOH等物质的量反应生成Na2CO3和一种气体单质,可联想到由无水醋酸钠与NaOH加热反应制取甲烷的脱羧反应: ,由此迁移可知,A为甲酸钠(HCOONa),与等物质的量NaOH进行脱羧反应生成Na2CO3和氢气:
,由此迁移可知,A为甲酸钠(HCOONa),与等物质的量NaOH进行脱羧反应生成Na2CO3和氢气: 。⑤?E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g·L-1。由计算可知气体Z的相对分子质量是17,则Z为NH3,由该反应:E + H2O → NaOH + NH3↑,可推知E由Na和N两种元素组成,再根据元素化合价可确定E是Na3N。
。⑤?E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g·L-1。由计算可知气体Z的相对分子质量是17,则Z为NH3,由该反应:E + H2O → NaOH + NH3↑,可推知E由Na和N两种元素组成,再根据元素化合价可确定E是Na3N。
由此可解答:
(1)A的化学式是? HCOONa ;Y的电子式是 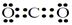
(2)X的沸点比同主族同类型物质要高的原因是:水分子间存在氢键,从而使分子间作用力增加,因此有较高的沸点。
(3)E与足量盐酸反应的化学方程式:Na3N + 4HCl =" 3NaOH" + NH4Cl 。
(4)D的饱和溶液中不断通入通Y析出C的离子方程式为:
2Na++CO32-+H2O+CO2 = 2NaHCO3↓
(5)根据2A →P +H2↑得到P,可知,2HCOONa →Na2C2O4 + H2↑,P为Na2C2O4,C2O42- + Ca2+ = CaC2O4↓,依据Ksp(CaC2O4) = c(Ca2+)?c(C2O42-) = 2.3×10-9,可计算出当CaC2O4完全沉淀时,溶液中Ca2+的物质的量浓度至少为:c(Ca2+) = mol?L-1
mol?L-1
(6)实验室Na2C2O4与足量HCl反应可得到H2C2O4 ,H2C2O4在浓硫酸条件下共热分解生成CO、CO2、H2O ( 即 H2C2O4 CO↑ + CO2↑+ H2O )。设计证明分解产物中存在还原性气体CO的实验为:将所得气体先通过足量NaOH溶液(或通过盛有固体NaOH的干燥管),再通过澄清石灰水,若无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在。
CO↑ + CO2↑+ H2O )。设计证明分解产物中存在还原性气体CO的实验为:将所得气体先通过足量NaOH溶液(或通过盛有固体NaOH的干燥管),再通过澄清石灰水,若无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在。
本题难度:困难