1、选择题 (2013?吉林模拟)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大CO的浓度
D.更换催化剂
参考答案:B
本题解析:提高CO的转化率可以使平衡正向进行,根据化学平衡移动原理来回答判断.
解:提高CO的转化率可以让平衡正向进行即可.
A、增加压强,该平衡会不会发生移动,故A错误;
B、降低温度,化学平衡向着放热方向即正向进行,故B正确;
C、增大CO的浓度,化学平衡向着正方向进行,但是一氧化碳的转化率降低,故C错误;
D、催化剂不会引起化学平衡的移动,故D错误.
故选B.
点评:本题考查学生化学平衡移动原理的应用方面的知识,属于基本知识的考查,注意知识的积累是解题的关键,难度不大.
本题难度:一般
2、选择题 低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)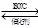 ?2N2(g)+3H2O(g) △H<0。在恒容的密闭容器中,下列有关说法正确的是: (? )
?2N2(g)+3H2O(g) △H<0。在恒容的密闭容器中,下列有关说法正确的是: (? )
A.平衡时,其他条件不变,增加NH3的浓度,反应速率会降低
B.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
C.其他条件不变,充入氦气,化学反应速率不变。
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
参考答案:BC
本题解析:该反应是气体系数增大的放热可逆反应,条件为恒容;
A:增加某一气体反应物浓度,速率均会升高
B:题设条件能表示出正逆反应速率相等即达到平衡
C:充入氦气,可物质浓度不变,正逆反应速率不变
D:升温,平衡右移,平衡常数减小
本题难度:一般
3、选择题 在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器
| 甲
| 乙
| 丙
| 丁
|
起始投料量
| 2 mol SO2+1 mol O2
| 1 mol SO2+0.5 mol O2
| 2 mol SO3
| 2 mol SO2+2 mol O2
|
反应放出或吸收的热量(kJ)
| a
| b
| c
| d
|
平衡时c(SO3) (mol·L-1)
| e
| f
| g
| h
|
?
下列关系正确的是( )
A.a=c;e=g ?B.a>2b;e>2f? C.a>d;e>h?D.c+98.3e>196.6
参考答案:B
本题解析:A、甲与丙的初始用量相当,会建立相同(等效)平衡,只不过建立平衡时反应的方向不同,所以e=g?而且a≠c,错误;B、甲与乙相比较,甲的用量比乙多一倍,在温度和体积相同的条件下,甲中平衡的建立可以在两个乙的基础上,再压缩为1L,但压缩时平衡会右移,所以a>2b,e>2f ,正确;C、甲与丁相比较,丁的平衡可以在甲平衡的基础上再增加1mol氧气,但平衡会向右移动,错误;D、设反应 2SO2 + O2 =" 2SO3" 的转化率为m,则有:e=m所以,反应 2SO3 =" 2SO2" + O2 的转化率为1-m,则:c=+196.6(1-m)所以,c+98.3e=196.6,错误。
本题难度:一般
4、填空题 )在一定体积的密闭容器中,进行如下化学方程式:CO(g)+H2O(g)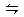 CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
?K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.5
|
回答下列问题:
⑴该反应化学平衡常数的表达式为K=?。
⑵该反应为?(填“放热”或“吸热”)反应。
⑶能判断该反应是否达到化学平衡状态的依据是?。
A.容器中压强不变
B.混合气体中c(CO)不变
C.υ(正,H2)=υ(逆,H2O)
D.c(CO2)=c(CO)