|
高中化学知识点总结《弱电解质电离平衡》高频考点特训(2020年练习版)(十)
2021-06-11 07:00:58
【 大 中 小】
|
1、选择题 下列说法正确的是
A.物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等
C.100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等
D.100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等
|
参考答案:C
本题解析:
试题解析: 醋酸为弱酸,不能完全电离,等体积、等物质的量浓度的盐酸和醋酸,氢离子浓度不等,起始时反应的速率不等,故A错误;100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸,酸的物质的量相等,但溶液中氢离子浓度不等,分别与足量的锌反应时,两者放出H2速率不等,质量相等,故B错误;100 mL pH=3的H2SO4和HCl溶液,氢离子的物质的量相等,与足量锌反应后,放出H2的质量相等,故C正确;100 mL pH=3的盐酸与醋酸溶液,氢离子总量不相等,与足量锌反应后,所得H2的质量不等,故D错误。
考点:弱电解质的电离
本题难度:一般
2、选择题 已知:常温下氢氟酸Ka=3.5 10-4 ,醋酸Ka=1.8 10-4 ,醋酸Ka=1.8 10-5,能正确描述在它们的钠盐溶液中,水电离出的c(H+)与盐浓度的关系曲线的是 10-5,能正确描述在它们的钠盐溶液中,水电离出的c(H+)与盐浓度的关系曲线的是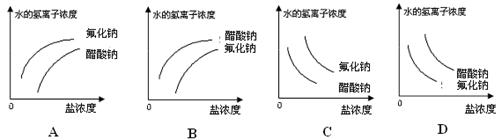
参考答案:B
本题解析:略
本题难度:一般
3、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ?;浓度为0.002mol/L的是?。
(4)??和??两种粒子物质的量之和等于0.01mol。
参考答案:H2O H++OH-、CH3COOH H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-(各1分,顺序可以颠倒) CH3COOH+OH-(各1分,顺序可以颠倒)
(2)7(1分) (3)Na+(1分)Cl-(1分) (4)CH3COOH、CH3COO-(2分,顺序可以颠倒)
本题解析:(1)醋酸是弱酸,盐酸是强酸,二者混合后反应生成醋酸和氯化钠,因此存在醋酸的电离平衡。又因为醋酸钠是过量的,所以还存在醋酸根离子的水解平衡。任何水溶液中都存在水的电离平衡,有关反应的方程式分别为H2O H++OH-、CH3COOH H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-。 CH3COOH+OH-。
(2)根据以上方程式可知,溶液中含有水分子、醋酸分子、氢离子、氢氧根离子、醋酸根离子、氯离子、钠离子,共7种微粒。
(3)已知0.01molCH3COONa,则根据离子守恒可知,浓度为0.01mol?L-1的是Na+,由0.002molHCl可知,浓度为0.002mol?L-1的是Cl-。
(4)已知0.01molCH3COONa,则根据原子守恒可知CH3COOH、CH3COO-微粒之和为0.01mol。
本题难度:一般
4、选择题 测得醋酸甲的pH:a,醋酸乙的pH:a+1。下列推断中正确的是(?)
A.醋酸甲中H+的物质的量是醋酸乙中的10倍
B.醋酸乙的电离程度比醋酸甲大
C.中和等物质的量的NaOH溶液需甲、乙两酸的体积之比为10∶1
D.甲、乙溶液加水稀释,当pH相等时甲需加更多的水
参考答案:B
本题解析:A选项错误,物质的量与溶液的体积有关;B选项正确,醋酸乙的pH大,说明溶液浓度小,CH3COOH电离程度大;C选项错误,甲、乙两酸中CH3COOH的物质的量之比不是10∶1,故所需甲、乙两酸的体积比也不是1∶10;D选项错误,溶液体积未知。
本题难度:一般
5、选择题 下列溶液中加入少量NaOH固体导电能力变化不大的是( )
A.NH3?H2O
B.CH3COOH
C.盐酸
D.H2O
参考答案:C
本题解析:
本题难度:一般
|