|
|
|
高考化学试题《水的电离平衡》试题特训(2020年最新版)(十)
2021-06-11 07:02:45
【 大 中 小】
|
1、选择题 下列物质的电离方程式,错误的是( )
A.HCl=H++Cl-
B.H2SO4=2H++SO42-
C.FeCl3=Fe3++Cl-
D.Ca(OH)2=Ca2++2OH-
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列溶液中一定呈中性的是
A.pH=7的溶液
B.由强酸、强碱等物质的量反应得到的溶液
C.c(H+)=c(OH—)的溶液
D.非电解质溶于水得到的溶液
|
参考答案:C
本题解析:A.只有在25℃,pH=7的溶液才是中性溶液,错误;B.由硫酸与氢氧化钠等物质的量反应生成硫酸氢钠,溶液呈酸性,错误;C.中性溶液的本质原因是c(H+)=c(OH—),正确;D.CO2是非电解质,溶于水形成酸性溶液,错误;选C。
考点:考查溶液的酸碱性判断。
本题难度:一般
3、选择题 已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
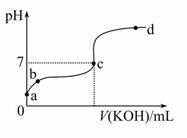
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度大小顺序为 或 或 。c点溶液中的离子浓度大小顺序为 。
(3)a、b、c三点中水的电离程度最大的是 ,滴定过程中宜选用 作指示剂。
参考答案:(1)4×10-4 mol·L-1
(2)c(CH3COO-)>c(H+)>c(K+)>c(OH-)
c(CH3COO-)>c(H+)=c(K+)>c(OH-)
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
c(K+)=c(CH3COO-)>c(H+)=c(OH-)
(3)c 酚酞
本题解析:(1)c(H+)=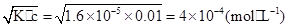
(2)b点时,由于滴加KOH溶液的体积未知,因此,溶液中的c(K+)与c(H+)相对大小未知,所以有3种可能情况。c点时可根据电荷守恒得出关系式。
(3)酸性溶液中水的电离被抑制,加入可水解的盐能促进水的电离,随着KOH的加入(c点时,KOH还未过量),溶液中CH3COOK的量不断增多,因此水的电离过程不断增大,故c点符合题意。由于酸碱恰好完全反应时溶液显碱性,故应该选择碱性范围内变色的指示剂酚酞。
本题难度:一般
4、填空题 (12分)已知: H2O  H+ + OH-(△H>0),KW为水的电离常数,完成下表。 H+ + OH-(△H>0),KW为水的电离常数,完成下表。
改变条件
| 电离平衡移动方向
| 溶液中c(H+)
| PH的变化
| KW
| 升高温度
|
|
|
|
| 加入酸
|
|
|
|
| 加入Na
|
|
|
|
| | | | | |
|
参考答案:
改变条件
电离平衡移动方向
溶液中c(H+)
PH的变化
KW
升高温度
右
增大
减小
增大
加入酸
左
增大
减小
不变
加入Na
左
减小
增大
不变
本题解析:考查外界条件对电离平衡的影响。
由于电离是吸热的,所以升高温度,促进水的电离。氢离子浓度,pH减小,水的离子积常数增大;加入强酸增大氢离子浓度,抑制水的电离,由于水的离子积常数只与温度有关系,所以是不变的;钠溶于水和水反应生成氢氧化钠,碱性增强,抑制水的电离。
本题难度:一般
5、选择题 pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+)为(mol/L):
A.(4×10-9 + 1×10-12) 1/5
B.(8×10-9 + 1×10-12) 1/5
C.5×10-10
D.5×10-12
|
参考答案:D
本题解析:pH=9的Ba(OH)2溶液中c(OH-)=10-5mol/L,pH=12的KOH溶液中c(OH-)=10-2mol/L,按4:1的体积比混合,c(OH-)=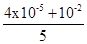 mol/L≈2×10-3mol/L,则c(H+)=5×10-12mol/L,答案选D
mol/L≈2×10-3mol/L,则c(H+)=5×10-12mol/L,答案选D
考点:溶液中pH的计算
本题难度:一般
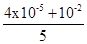 mol/L≈2×10-3mol/L,则c(H+)=5×10-12mol/L,答案选D
mol/L≈2×10-3mol/L,则c(H+)=5×10-12mol/L,答案选D