| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《水的电离平衡》试题特训(2020年最新版)(八)
参考答案:C 本题解析:根据题意知,VL0.10mol?L-1盐酸中含有氢离子的物质的量为0.1Vmol,VL0.06mol?L-1Ba(OH)2溶液中含有氢氧根离子的物质的量为:2×VL×0.06mol?L-1=0.12Vmol,两溶液混合后氢氧根离子过量,溶液显碱性,反应后的溶液中氢氧根离子浓度为:(0.12Vmol—0.1Vmol)/2VL=0.01mol/L,该溶液中氢离子浓度为1×10-12mol/L,pH=12,选C。 本题难度:一般 2、选择题 下列电离方程式错误的是( ) 参考答案:C 本题解析: 本题难度:简单 3、选择题 室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为( ) |
参考答案:D
本题解析:室温下某无色透明溶液中由水电离出的H+和OH-浓度的乘积为1×10-24,则c(H+)=1×10-12,溶液为酸或碱溶液,A.HCO3-既能与酸反应又能与碱反应,且HCO3-、Al3+相互促进水解,则离子一定不能共存,故A错误;B.酸溶液中氢离子与I-、NO3-发生氧化还原反应,碱溶液中OH-与NH4+结合生成弱电解质,则一定不能共存,故B错误;C.该组离子之间不反应,能共存,但MnO4-为紫色,与无色溶液不符,故C错误;D.碱溶液中该组离子之间不反应,则能共存,但酸溶液中氢离子分别与SiO32-、OH-、SO32-反应,则不能共存,即此溶液中可能大量共存,D正确;答案选D
考点:离子共存
本题难度:一般
4、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HB物质的量浓度(mol/L) | KOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
参考答案:(1)若a=7,则HB为强酸,若a>7,则为弱酸
(2)否;C (3)弱;c(Na+)>c(B-)>c(OH-)>c(H+)
(4)10-5;10-5-10-9
本题解析:(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生成的产物是KB,对KB溶液分析,若a=7,说明HB是强酸,若a>7,说明溶液因B-的水解而显碱性,则HB是弱酸。(2)c1不一定等于0.2。当HB是强酸时等于0.2;当HB是弱酸时,大于0.2。因为pH=7,说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(K+)=c(B-)。(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7。说明B-水解,得到HB是弱酸,其他易推知。(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9mol/L,则由水电离产生的c(H+)=c(OH-)=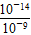 =10-5(mol/L),由电荷守恒得:c(K+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=(10-5-10-9)mol/L。
=10-5(mol/L),由电荷守恒得:c(K+)+c(H+)=c(OH-)+c(B-),则c(Na+)-c(B-)=c(OH-)-c(H+)=(10-5-10-9)mol/L。
本题难度:困难
5、选择题 用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为( )
A.0.5 mol/L
B.2 mol/L
C.l mol/L
D.无法确定
参考答案:C
本题解析:
正确答案:C
该过程了生两个反应,先电解Cu (NO3)2溶液,后电解水
2H2O 2H2↑ + O2↑
2H2↑ + O2↑
0.5mol 0.25mol
2Cu(NO3)2+2H2O 2Cu+O2↑+4HNO3
2Cu+O2↑+4HNO3
0.5mol 0.5mol
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《生活中的有.. | |